Некоторые заметки по экс. Электрокардиостимулятор: что это, эффективность, операция по установке Что такое экс в кардиологии
В главе рассматриваются актуальные проблемы электрокардиотерапии сердечной недостаточности (установка кардиоресинхронизирующих устройств) в том числе у больных, относящихся к категории высокого риска внезапной сердечной смерти (использование электрокардиостимуляторов, кардиовертеров-дефибрилляторов). Обсуждаются этиология, патогенез, классификация, клинические проявления, возможности методов клинической, инструментальной и интервенционной диагностики, показания и противопоказания к электрокардиотерапии.
Ключевые слова: электрокардиостимуляция, дисфункция синусового узла, блокады сердца, кардиовертеры-дефибрилляторы, внезапная сердечная смерть, сердечный арест, желудочковая тахикардия, фибрилляция желудочков, сердечная недостаточность, желудочковая десинхронизация, кардиоресинхронизирующие устройства.
постоянная электрокардиостимуляция
Имплантация электрокардиостимуляторов
Постоянная электрокардиостимуляция реализуется путем имплантации системы электрокардиостимуляции, состоящей из электрокардиостимулятора (ЭКС) и электродов. Как правило, оперативное вмешательство выполняется с использованием сочетанной анестезии (местная анестезия и парентеральные седативные средства). Перед операцией с помощью программатора оценивают состояние батареи электрокардиостимулятора. Для имплантации электродов в большинстве случаев используется эндокардиальная методика. Электроды под флюороскопическим контролем устанавливают и фиксируют в правом предсердии и/или правом желудочке, с помощью наружного стимулятора проводится их тестирование (оцениваются импедансы, пороги стимуляции и амплитуда спонтанных биоэлектрических потенциалов). Ложе аппарата ЭКС формируется в подключичной области подкожно или субфасциально. Для профилактики инфекционных осложнений внутривенно назначают антибиотики.
Единый номенклатурный код
В настоящее время в международной практике для обозначения имплантируемых ЭКС и кардиовертеров-дефибрилляторов используется пятибуквенный номенклатурный код, который был разработан рабочей группой Североамериканского общества по электрокардиостимуляции и электрофизиологии (NASPE) и Британской группой по электрокардиостимуляции и электрофизиологии (BPEG) (см. табл. 2.1).
Буква в первой позиции кода обозначает камеру сердца, к которой поступает стимулирующий импульс. Вторая буква указывает на камеру сердца, из которой электрокардиостимулятором воспринимается спонтанный биоэлектрический сигнал. Буква в третьей позиции кода иллюстрирует режим, в котором система стимуляции
Таблица 2.1
Единый код ЭКС номенклатура NBG NASPE/BPEG (1987 г.)
отвечает на спонтанную электрическую активность сердца (I - стимуляция запрещается спонтанным сигналом из сердца, т.е. если есть спонтанная электрическая активность, то устройство не работает; Т - стимуляция запускается спонтанным сигналом из сердца, т.е. спонтанная электрическая активность предсердий запускает P-синхронизированную стимуляцию желудочков при двухкамерной ЭКС). Четвертая позиция кода характеризует возможности наружного (неинвазивного) программирования параметров стимуляции, а также наличие в системе ЭКС частотно-адаптивной функции. Буква в пятой позиции свидетельствует о наличии в системе ЭКС функции антитахикардитической стимуляции, включая кардиоверсию или дефибрилляцию.
В октябре 2001 г. рабочими группами NASPE и BPEG была предложена обновленная версия пятибуквенного номенклатурного кода для антибрадикардитических устройств, приведенного в табл. 2.2.
Как правило, для обозначения вида и режима электрокардиостимуляции используются первые три буквы кода (например: VVI, AAI, DDD), а буква R (IV позиция) используется для обозначения программируемых ЭКС с функцией частотной адаптации сердечного
ритма (например, VVIR, AAIR, DDDR).
Под частотной адаптацией или модуляцией следует понимать способность устройства увеличивать или уменьшать частоту стимуляции в пределах запрограммированных величин при активации сенсора нагрузок во время нарастания или прекращения физической активности, изменения психо-эмоционального статуса пациента.
Режимы постоянной электрокардиостимуляции
VVI - однокамерная желудочковая стимуляция в режиме «по требованию». Под данным режимом стимуляции понимают однокамерную "demand"-стимуляцию желудочков, которая осуществляется при снижении частоты спонтанного ритма сердца ниже установленного значения фиксированной частоты стимуляции и прекращается в случае превышения спонтанным ритмом сердца установленных частотных границ (I - ингибирующий механизм управления работы ЭКС). На рис. 2.1 приведен фрагмент ЭКГ, иллюстрирующий элек-
Таблица 2.2
Обновленный единый код ЭКС - номенклатура NBG - NASPE/BPEG (2001)

 Рис. 2.1.
Фрагмент
ЭКГ, иллюстрирующий однокамерную желудочковую стимуляцию «по
требованию» (VVI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Рис. 2.1.
Фрагмент
ЭКГ, иллюстрирующий однокамерную желудочковую стимуляцию «по
требованию» (VVI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. V-V-интервал - интервал между двумя последовательными желудочковыми стимулирующими импульсами - интервал желудочковой стимуляции (например, при базовой частоте стимуляции 60 имп/мин V-V-интервал равен 1000 мс); V-R-интервал - интервал между стимулирующим импульсом и последующим спонтанным сокращением желудочков сердца (при базовой частоте стимуляции 60 имп/мин V-R-интервал менее 1000 мс); R-V-интервал - интервал между спонтанным сокращением желудочков сердца и последующим стимулирующим импульсом в случае снижения частоты спонтанных сокращений желудочков ниже базовой частоты стимуляции (при базовой частоте стимуляции 60 имп/мин R-V-интервал равен 1000 мс)
трокардиостимуляцию в режиме VVI-60 имп/мин (базовая частота стимуляции).
Базовая частота стимуляции (нижняя граница частоты стимуляции) - частота, с которой осуществляется стимуляция желудочков или предсердий в отсутствие спонтанных сокращений (спонтанного ритма). Как показано на рис. 2.1, при снижении спонтанной частоты желудочковых сокращений менее 60 уд/мин (R-R интервал более 1000 мс) начинает осуществляться однокамерная стимуляция желудочков с частотой 60 имп/мин (V-V интервал 1000 мс). В том случае, если после нанесенного импульса в течение 1000 мс происходит детекция спонтанного желудочкового сокращения,
работа кардиостимулятора ингибируется (ингибирующий механизм управления работы ЭКС), и пациент находится на спонтанном сердечном ритме (при этом ЧСС более 60 уд/мин). Если после спонтанного сокращения желудочков в течение 1000 мс не происходит детекция очередного спонтанного комплекса QRS, возобновляется стимуляция желудочков с частотой 60 имп/мин. Необходимо отметить, что интервалы V-V и R-V равны и превышают интервал V-R (см. рис. 2.1).
Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом желудочке сердца. Недостатками данного вида электрокардиотерапии является то, что в ходе стимуляции нарушается адекватная предсердно-желудочковая синхронизация, что и обусловливает клинические признаки хронотропной недостаточности. По мнению большинства авторов, это является основным механизмом развития синдрома электрокардиостимулятора.
AAI - однокамерная предсердная стимуляция в режиме «по требованию» (рис. 2.2). Под данным режимом стимуляции понимают однокамерную «demand» стимуляцию предсердий, которая осуществляется при снижении частоты спонтанного предсердного ритма ниже установленного значения фиксированной частоты стимуляции и прекращается в случае превышения спонтанным ритмом сердца установленных частотных границ (I - ингибирующий механизм управления работы ЭКС).
При снижении частоты спонтанного предсердного ритма (рис. 2.2) ниже базовой частоты стимуляции (P-P-интервал больше запрограммированного интервала стимуляции (A-A-интервал), при базовой частоте стимуляции 60 имп/мин A-A-интервал равен 1000 мс) осуществляется однокамерная стимуляция предсердий с базовой частотой. В ситуации, когда после нанесенного на предсердия стимулирующего импульса в течение интервала стимуляции регистрируется спонтанное сокращение предсердий, работа кардиостимулятора ингибируется, и пациент находится на спонтанном синусовом ритме (при этом ЧСС превышает базовую частоту стимуляции). Если после спонтанного предсердного сокращения в течение интервала стимуляции не происходит детекция очередной спонтанной Р-волны, возобновляется предсердная стимуляция с фиксированной частотой. Необходимо отметить, что интервалы A-A и P-A равны и превышают интервал A-P (рис. 2.2).
 Рис. 2.2.
Фрагмент
ЭКГ, иллюстрирующий однокамерную предсердную стимуляцию «по требованию»
(AAI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Рис. 2.2.
Фрагмент
ЭКГ, иллюстрирующий однокамерную предсердную стимуляцию «по требованию»
(AAI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. A-A-интервал - интервал между двумя последовательными предсердными стимулирующими импульсами - интервал предсердной стимуляции (например, при базовой частоте стимуляции 60 имп/мин A-A-интервал равен 1000 мс); A-P-интервал - интервал между стимулирующим импульсом и последующим спонтанным сокращением предсердий сердца (при базовой частоте стимуляции 60 имп/мин A-P-интервал менее 1000 мс); P-A-интервал - интервал между спонтанным сокращением предсердий сердца и последующим стимулирующим импульсом в случае снижения частоты спонтанных сокращений предсердий ниже базовой частоты стимуляции (при базовой частоте стимуляции 60 имп/мин P-A-интервал равен 1000 мс)
Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом предсердии сердца. При данном виде электрокардиотерапии сохраняется адекватная предсердно-желудочковая синхронизация, что позволяет определить ее как физиологическую. Недостатками AAI-ЭКС является отсутствие возможности частотной адаптации сердечного ритма у пациентов с хронотропной недостаточностью, так как нет функции частотной модуляции (R в четвертой позиции кода), а также невозможность использовать данный вид ЭКС у пациентов с нарушением атриовентрикулярной проводимости.
VVIR - однокамерная желудочковая частотно-адаптивная стимуляция. При данном виде стимуляции осуществляется однокамерная частотно-адаптивная стимуляция желудочков с ингибирующим механизмом управления работы ЭКС. Ингибирующий механизм управления подразумевает отсутствие (прекращение) стимуляции
при адекватной электрической активности сердца, сенсируемой устройством в указанной камере сердца (V - желудочек, т.е. R-запре- щающая стимуляция желудочков, где R - зубец комплекса QRS, не путать с R - функция частотной модуляции). Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом желудочке сердца. Данный вид электрокардиотерапии, так же как и в VVI-ЭКС, приводит к нарушению адекватной предсердно-желудочковой синхронизации.
AAIR - однокамерная предсердная частотно-адаптивная стимуляция. При данном виде стимуляции осуществляется однокамерная частотно-адаптивная стимуляция предсердий с ингибирующим механизмом управления работы ЭКС. Ингибирующий механизм управления подразумевает отсутствие (прекращение) стимуляции при адекватной электрической активности сердца, сенсируемой устройством в указанной камере сердца (А - предсердие, т.е. P-запрещающая стимуляция предсердий, где Р - зубец, иллюстрирующий электрическую активацию предсердий). Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом предсердии сердца (невозможно использовать у пациентов с нарушениями АВ-проводимости). При данном виде электрокардиотерапии сохраняется адекватная предсердно-желудочковая синхронизация и имеется возможность частотной адаптации (модуляция) ритма сердца у пациентов с признаками хронотропной недостаточности.
VDD - однокамерная Р-синхронизированная стимуляция, при которой осуществляется стимуляция желудочков с сохранением адекватной предсердно-желудочковой синхронизации. При данном виде ЭКС используется как ингибирующий (R-запрещающая стимуляция желудочков, где R - зубец комплекса QRS, не путать с R - функция частотной модуляции), так и триггерный механизмы управления работы электрокардиостимулятора. Триггерный механизм управления подразумевает запуск стимуляции желудочков в ответ на адекватную электрическую активность сердца, сенсируемую в предсердиях (P-индуцированная стимуляция желудочков, где Р - зубец, иллюстрирующий электрическую активацию предсердий).
На рис. 2.3 приведен фрагмент ЭКГ, иллюстрирующий электрокардиостимуляцию в режиме VDD с базовой частотой стимуляции 60 имп/мин. Необходимым условием эффективной стимуляции в режиме VDD является превышение частоты спонтанного предсер-
 Рис. 2.3.
Фрагмент ЭКГ, иллюстрирующий однокамерную предсердно-синхронизированную стимуляцию желудочков (VDD-стимуляция). Примечание.
P
- спонтанное сокращение предсердий (спонтанная P-волна); AV -
предсердно-желудочковая (атриовентрикулярная) задержка; V -
стимулирующий импульс, нанесенный на желудочки (синхронизированный со
спонтанной P-волной)
Рис. 2.3.
Фрагмент ЭКГ, иллюстрирующий однокамерную предсердно-синхронизированную стимуляцию желудочков (VDD-стимуляция). Примечание.
P
- спонтанное сокращение предсердий (спонтанная P-волна); AV -
предсердно-желудочковая (атриовентрикулярная) задержка; V -
стимулирующий импульс, нанесенный на желудочки (синхронизированный со
спонтанной P-волной)
дного ритма базовой частоты стимуляции. После восприятия спонтанного предсердного сигнала запускается интервал атриовентрикулярной (АВ) задержки. Атриовентрикулярная (АВ) задержка - это интервал, который начинается от предсердного события (искусственно вызванного или спонтанного) и заканчивается нанесением стимула на желудочек при условии того, что в этот временной период не будет воспринято спонтанное желудочковое сокращение. В большинстве случаев значение АВ-задержки устанавливается в пределах от 150 до 180 мс. Таким образом, если за период АВ-задержки не происходит спонтанного сокращения желудочков, осуществляется P-синхронизированная стимуляция желудочков. Адекватная предсердно-желудочковая синхронизация будет сохраняться до момента достижения спонтанным ритмом предсердий частоты, равной установленному значению максимальной частоты синхронизации. Максимальная частота синхронизации (верхняя граница частоты стимуляции) - частота, до достижения которой синхронизированная со спонтанной предсердной активностью стимуляция желудочков осуществляется в соотношении 1:1, а при превышении ее начинается пейсмейкерная периодика Венкебаха.
При VDD-стимуляции точка приложения ЭКС расположена в правом желудочке сердца, а точки детекции спонтанных биоэлектрических сигналов - в правом предсердии и правом желудочке.
Существенным недостатком данного вида ЭКС является то, что при снижении частоты спонтанного предсердного ритма ниже установленных значений базовой частоты стимуляции нарушается предсердно-желудочковая синхронизация (режим VDD переходит в режим VVI), так как отсутствует возможность стимуляции предсердий. Данный вид постоянной электрокардиотерапии не применим у пациентов с признаками хронотропной недостаточности синусового узла.
DDD - двухкамерная электрокардиостимуляция. Данный вид стимуляции позволяет сохранять адекватную предсердно-желудочковую синхронизацию постоянно, так как при снижении частоты спонтанного предсердного ритма ниже установленных значений минимальной (базовой) частоты стимуляции осуществляется последовательная стимуляция как предсердий, так и желудочков. В ситуации, когда частота спонтанного предсердного ритма превышает минимальную частоту стимуляции, осуществляется однокамерная Р-синхронизированная (т.е. предсердно-синхронизированная) стимуляция желудочков (VDD-ЭКС).
При DDD-ЭКС используется как ингибирующий (P- и R-запре- щающая стимуляция, где R - зубец комплекса QRS, не путать с R - функцией частотной модуляции, а Р - зубец, иллюстрирующий электрическую активацию предсердий), так и триггерный (P-инду- цированная стимуляция желудочков, где Р - зубец, иллюстрирующий электрическую активацию предсердий) механизмы управления работы электрокардиостимулятора. Если частота спонтанного предсердного ритма ниже установленного значения базовой частоты стимуляции, наносится стимулирующий импульс на предсердия. В том случае, если за период запрограммированной АВ-задержки не происходит спонтанного сокращения, стимулятором наносится импульс на желудочки (рис. 2.4).
При DDD-ЭКС точки приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположены в двух камерах сердца (в правом предсердии и правом желудочке). Недостатком данного вида ЭКС является отсутствие возможности частотной адаптации сердечного ритма у пациентов с признаками хронотропной недостаточности.
В зависимости от частоты спонтанного предсердного ритма и состояния атриовентрикулярной проводимости возможны несколько вариантов двухкамерной DDD-стимуляции.

Рис. 2.4. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. A - стимулирующий импульс, нанесенный на предсердия; AV - предсердно-желудочковая (атриовентрикулярная) задержка; V - стимулирующий импульс, нанесенный на желудочки; A-A-интервал - интервал между двумя последовательными предсердными стимулирующими импульсами - интервал предсердной стимуляции (при базовой частоте стимуляции 60 имп/мин A-A интервал равен 1000 мс); V-V-интер- вал - интервал между двумя последовательными желудочковыми стимулирующими импульсами - интервал желудочковой стимуляции (при базовой частоте стимуляции 60 имп/мин V-V интервал равен 1000 мс); V-A-интервал - интервал между желудочковым импульсом и последующим стимулирующим импульсом на предсердия (V-A равен V-V (A-A) минус AV-задержка))
При низкой частоте спонтанного предсердного ритма (ниже базовой частоты стимуляции) и нарушенном атриовентрикулярном проведении будет осуществляться двухкамерная «секвенциальная» электрокардиостимуляция с установленной базовой частотой (рис. 2.5).
В ситуации, когда частота спонтанного предсердного ритма ниже базовой частоты стимуляции, а АВ-проводимость не нарушена (т.е. в период установленной атриовентрикулярной задержки происходят спонтанные желудочковые сокращения), осуществляется предсердная стимуляция с установленной базовой частотой (рис. 2.6).
При сохраненной адекватной спонтанной активности предсердий (частота предсердного ритма превышает базовую частоту сти-
 Рис. 2.5.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция).
Рис. 2.5.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция).
Примечание. A - стимулирующий импульс, нанесенный на предсердия; V - стимулирующий импульс, нанесенный на желудочки
 Рис. 2.6.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию при сохраненной нормальной АВ-проводимости (AAI-сти- муляция).
Рис. 2.6.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию при сохраненной нормальной АВ-проводимости (AAI-сти- муляция).
Примечание. A - стимулирующий импульс, нанесенный на предсердия
муляции), но в условиях нарушенной АВ-проводимости (за период установленной АВ-задержки не происходит спонтанных сокращений желудочков), будет реализована предсердно-синхронизированная стимуляция желудочков в режиме VDD (рис. 2.7). Адекватная предсердно-желудочковая синхронизация будет сохраняться до момента достижения спонтанным ритмом предсердий частоты, равной установленному значению максимальной частоты синхронизации.
Если имеются эпизоды, когда частота предсердного ритма сердца превышает базовую частоту стимуляции и нет признаков нарушения атриовентрикулярной проводимости, будет происходить полное ингибирование работы электрокардиостимулятора.
DDDR - двухкамерная частотно-адаптивная электрокардиостимуляция. Данный вид постоянной электрокардиостимуляции является наиболее современным и полностью устраняет недостатки вышеописанных режимов ЭКС.
 Рис. 2.7.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (VDD-стимуляция)
Рис. 2.7.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (VDD-стимуляция)
Блокады сердца Определение
Под блокадами сердца понимают полные или частичные нарушения проведения импульсов, возникающие на различном уровне проводящей системы сердца вследствие изменений функционального или органического характера (см. табл. 2.3).
Общая классификация
По локализации:
1. Синоатриальные блокады.
2. Внутри- и межпредсердные блокады.
3. Атриовентрикулярные блокады.
4. Фасцикулярные блокады. По степени выраженности: Блокада I степени (неполная). Блокада II степени (неполная). Блокада III степени (полная). По стойкости: Преходящая. Перемежающаяся. Постоянная.
Латентная.
Дисфункция синусового узла Определение
Дисфункция синусового узла - это гетерогенный клинический синдром различной этиологии, связанный с нарушением хронотропной функции структурных компонентов, составляющих зону синоаурикулярного узла.
Классификация
Клинические формы дисфункции синусового узла (М.С. Кушаковский, 1992):
Синдром слабости синусового узла (СССУ) - дисфункции синусового узла органической природы.
Регуляторные (вагусные) дисфункции синусового узла.
Лекарственные (токсические) дисфункции синусового узла. Электрокардиографические эквиваленты СССУ:
1. Синусовая брадикардия с частотой менее 40 уд/мин в состоянии покоя.
2. Синус-арест (остановка синусового узла).
Критерии определения минимальной продолжительности синусовой паузы, которую можно было бы классифицировать как эпизод синус-ареста, не определены. Однако возникновение пауз более 3 с позволяет с большой долей вероятности предположить остановку синусового узла.
3. Синоатриальная (СА) блокада по степени выраженности подразделяется на:
СА-блокаду I степени - характеризуется замедлением проведения импульсов от синоатриального узла к предсердиям, что не находит отражения на ЭКГ;
СА-блокаду II степени тип I (с периодикой Самойлова-Венкебаха) - при этом наблюдается постепенное укорочение интервалов Р-Р, предшествующих выпадению зубца Р;
СА-блокаду II степени тип II - на ЭКГ отмечается выпадение одного или нескольких зубцов Р, что приводит к возникновению пауз, кратных двум или нескольким интервалам Р-Р;
СА-блокаду III степени - ни один импульс из синоатриального узла не проводится на предсердия.
4. Чередование замедленного синусового ритма или медленного замещающего ритма с пароксизмами тахикардии, как правило, суправентрикулярного происхождения (синдром брадикардии-тахикардии).
Наиболее часто наблюдаемым пароксизмальным суправентрикулярным нарушением ритма сердца у пациентов с СССУ является фибрилляция предсердий (синдром Шорта). Однако также возможна верификация трепетания предсердий, ускоренного ритма из АВсоединения, реципрокной АВ-узловой тахикардии. В редких случаях может наблюдаться и желудочковая тахикардия.
5. Замедленное восстановление функции синусового узла (появление синусовых пауз) после электрической или медикаментозной кардиоверсии.
Атриовентрикулярные блокады Определение
Атриовентрикулярная блокада - замедление или полное нарушение проведения импульсов от предсердий к желудочкам. Классификация По степени выраженности:
1. АВ-блокада I степени - определяется как аномальное удлинение интервала P-Q (более 210-220 мс).
2. АВ-блокада II степени тип Мобиц I (с периодикой СамойловаВенкебаха) - для нее характерно прогрессивное удлинение интервала P-Q до возникновения блокирования проведения. Максимальный прирост интервала P-Q отмечается между первым и вторым сокращением в цикле Венкебаха. Интервал P-Q имеет наибольшую продолжительность в сокращении, предшествующем блокированию АВ-проведения, и наименьшую - после выпавшего комплекса QRS. В большинстве случаев данный вид блокады ассоциируется с узким комплексом QRS.
3. АВ-блокада II степени тип Мобиц II - интервалы P-Q до и после блокирования проведения имеют фиксированную продолжительность. Для данного типа АВ-блокады в большинстве случаев характерен широкий комплекс QRS. При АВ-блокаде II степени с проведением 2:1 она не может быть классифицирована на первый или второй тип, однако о типе блокады можно косвенно судить по ширине комплекса QRS.
4. АВ-блокада III степени - АВ-проведение отсутствует полностью, на ЭКГ признаки полной АВ-диссоциации.
По анатомическому уровню нарушения проводимости:
супрагисиальные АВ-блокады;
Интрагисиальные АВ-блокады;
Инфрагисиальные АВ-блокады.
Фасцикулярные блокады Определение
Фасцикулярная блокада - нарушение проведения импульсов в системе Гиса-Пуркинье.
Классификация
I. Монофасцикулярные блокады:
1. Блокада правой ножки пучка Гиса.
2. Блокада передневерхнего разветвления левой ножки пучка Гиса.
3. Блокада задненижнего разветвления левой ножки пучка Гиса.
II. Бифасцикулярные блокады:
1. Односторонняя - блокада левой ножки пучка Гиса.
2. Двухсторонняя:
а) правой ножки и передневерхнего разветвления левой ножки пучка Гиса.
б) правой ножки и задненижнего разветвления левой ножки пучка Гиса.
III. Трифасцикулярные блокады - сочетание АВ-блокады с любой из вышеперечисленных бифасцикулярных блокад.
IV. Периферические блокады (системы Гиса-Пуркинье).
Патофизиология блокад сердца
Дисфункция синусового узла и АВ-блокады характеризуются клиническими проявлениями хронотропной некомпетентности вследствие задержки или отсутствия проведения импульсов от синусового узла к предсердиям или от предсердий к желудочкам. Клиническая симптоматика обусловлена гипоперфузией жизненно важных органов, в особенности головного мозга и сердца, как результат синдрома малого сердечного выброса вследствие брадисистолии (см. табл. 2.4).
Нарушение меж- и внутрижелудочкового проведения импульсов приводит к десинхронизации работы правого и левого желудочков, что способствует прогрессии сердечной недостаточности, повышает риск развития пароксизмальных желудочковых нарушений ритма сердца.
Таблица 2.3
Этиология блокад сердца

 Таблица 2.4
Таблица 2.4
Пациенты с СССУ могут иметь клиническую симптоматику, обусловленную тахикардией, брадикардией или сочетанием данных форм нарушений сердечного ритма. Для определения показаний к постоянной электрокардиотерапии у данной категории пациентов необходимо выявить четкую связь клинической симптоматики с аритмией. Определение этой связи может быть затруднено в связи с преходящим характером нарушений ритма сердца и проводимости.
Клинические проявления при нарушении атриовентрикулярного проведения аналогичны симптомам при СССУ. Наиболее характерными являются жалобы на общую слабость, быструю утомляемость,
наличие пре- и синкопальных состояний, а также на развернутые приступы Морганьи-Адамса-Стокса (см. табл. 2.4).
У пациентов с биили трифасцикулярными блокадами часто отмечаются слабость, головокружение, снижение толерантности к физическим нагрузкам, синкопальные состояния. Основными причинами синкопальных состояний у данных пациентов могут быть преходящие нарушения атриовентрикулярной проводимости высокой степени, пароксизмальные желудочковые нарушения ритма сердца.
при синдроме слабости синусового узла (ACC/AHA/NASPE, 2002)
Класс I:
1. Дисфункция синусового узла с документированной симптомной синусовой брадикардией, включающей частые паузы, обуславливающие симптомы. У некоторых пациентов брадикардия является ятрогенной и возникает вследствие длительной медикаментозной терапии и/или ее передозировки.
2. Симптомная хронотропная недостаточность. Класс IIa:
1. Дисфункция синусового узла, возникающая спонтанно или как результат необходимой медикаментозной терапии с ЧСС менее 40 в минуту, когда четкая связь симптомов с брадикардией не документирована.
2. Синкопе неясного генеза со значимыми нарушениями функции синусового узла, выявленными или спровоцированными при электрофизиологическом исследовании.
Класс IIb:
1. Постоянная ЧСС при пробуждении менее 40 в минуту у пациентов с незначительной симптоматикой.
Класс III:
1. Дисфункция синусового узла у асимптомных пациентов, включая тех, у кого синусовая брадикардия (ЧСС менее 40 в минуту) является следствием длительной медикаментозной терапии.
2. Дисфункция синусового узла у пациентов с симптомами, похожими на брадикардитические, когда четко документировано отсутствие их связи с редким ритмом.
3. Дисфункция синусового узла с симптомной брадикардией в результате неадекватной медикаментозной терапии.
На наш взгляд, заслуживают внимания показания к постоянной электрокардиотерапии пациентов с синдромом слабости синусового узла, разработанные Д.Ф. Егоровым с соавт. (1995).
Клинико-электрофизиологические показания:
1) наличие приступов Морганьи-Адамса-Стокса на фоне брадиаритмии либо при купировании пароксизмов наджелудочковой тахикардии;
2) прогрессирующая недостаточность кровообращения на фоне брадиаритмии;
3) отсутствие эффекта или невозможность проведения медикаментозной терапии СССУ при наличии клинических проявлений брадиаритмии;
4) спонтанная асистолия по данным мониторирования ЭКГ длительностью 2000-3000 мс и более;
5) остановка или отказ синусового узла;
6) синоатриальная блокада степени с периодами асистолии более 2000 мс;
7) периодическое урежение числа сокращений желудочков менее 40 уд./мин, особенно в ночные часы.
Электрофизиологические показания:
Время восстановления функции синусового узла (ВВФСУ) - 3500 мс и более;
Коррегированное время восстановления функции синусового
узла (КВВФСУ) - 2300 мс и более;
Время истинной асистолии после стимуляции предсердий - 3000 мс и более;
Время синоатриального проведения (ВСАП) более 300 мс при наличии:
Признаков «вторичных» пауз во время ЭФИ;
- «парадоксальной» реакции на введение атропина во время
Признаков синоатриальной блокады на ЭКГ;
Отрицательная проба с атропином (прирост ЧСС менее 30% от исходной, уменьшение ВВФСУ менее чем на 30% от исходного).
Необходимо также добавить, что проведение постоянной электрокардиостимуляции абсолютно показано пациентам с постоянной формой фибрилляции предсердий с редким проведением на желудочки, симптоматичной брадикардией и клиническими проявлениями сердечной недостаточности. Напротив, имплантация ЭКС не пока-
зана при отсутствии клинической симптоматики на фоне брадиаритмии при фибрилляции предсердий (с ЧСС менее 40 в 1 минуту), даже если длительность отдельных интервалов R-R превышает 1500 мс.
у взрослых (ACC/AHa/nASPE, 2002)
Класс I:
1. АВ-блокада III степени и далеко зашедшая АВ-блокада II степени на любом анатомическом уровне, связанные с любым из следующих условий:
1) симптомная брадикардия (включая сердечную недостаточность) предположительно вследствие АВ-блокады;
2) аритмия или другие медицинские обстоятельства, требующие назначения лекарственных препаратов, вызывающих симптомную брадикардию;
3) документированные периоды асистолии равные 3,0 сек или более, а также любой выскальзывающий ритм менее 40 уд/мин при пробуждении, у асимптомных пациентов;
4) состояние после катетерной радиочастотной абляции АВсоединения (нет исследований по оценке исхода без электрокардиостимуляции, стимуляция всегда планируется в данных ситуациях, за исключением тех случаев, когда была выполнена процедура модификации АВ-соединения);
5) АВ-блокада после кардиохирургических вмешательств, когда не ожидается ее спонтанное разрешение;
6) нейромышечные заболевания в сочетании с АВ-блокадой, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с симптомами или без них, так как возможно непредвиденное ухудшение АВ-проводимости.
2. АВ-блокада II степени вне зависимости от типа и уровня поражения при сочетании с симптомной брадикардией.
Класс IIa:
1. Асимптомная АВ-блокада III степени на любом анатомическом уровне со средней частотой сокращения желудочков при пробуждении 40 уд/мин или более, особенно при наличии кардиомегалии или дисфункции левого желудочка.
2. Асимптомная АВ-блокада II степени тип Мобиц II с узким комплексом QRS (когда при АВ-блокаде II степени тип Мобиц II имеется широкий комплекс QRS, класс рекомендации становится первым).
3. Асимптомная АВ-блокада I степени на интраили инфрагисиальном уровне, выявленная при электрофизиологическом исследовании, проведенном по другому поводу.
4. АВ-блокада I или II степени с симптоматикой, сходной с синдромом электрокардиостимулятора.
Класс IIb:
1. Значимая АВ-блокада I степени (P-Q более 300 мс) у пациентов с дисфункцией левого желудочка и симптомами застойной сердечной недостаточности, у которых укороченная АВ-задержка приводит к улучшению гемодинамики, предположительно за счет снижения давления наполнения левого предсердия.
2. Нейромышечные заболевания, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с любой степенью АВ-блокады, симптоматичная или нет, так как возможно непредвиденное ухудшение АВ-проводимости.
Класс III:
1. Асимптомная АВ-блокада I степени.
2. Асимптомная АВ-блокада I степени на супрагисиальном уровне (уровень АВ-узла) или при отсутствии данных об интраили инфрагисиальном уровне блока.
3. Ожидаемое разрешение АВ-блокады и/или малая вероятность ее рецидива (например, токсическое действие лекарств, болезнь Лайма, гипоксия при апноэ во время сна в отсутствие симптоматики).
при хронической бифасцикулярной и трифасцикулярной блокаде
(ACC/AHA/NASPE, 2002)
Класс I:
1. Преходящая АВ-блокада III степени.
2. АВ-блокада II степени тип Мобиц II.
3. Альтернирующая блокада ножек пучка Гиса.
Класс IIa:
1. Синкопальные состояния при недоказанной связи с АВ-блокадой, когда другие их причины исключены, в особенности желудочковая тахикардия.
2. Случайно выявленное при электрофизиологическом исследовании значительное удлинение интервала H-V (более 100 мс) у асимптомных пациентов.
3. Случайно выявленный при электрофизиологическом исследовании нефизиологический инфрагисиальный блок, вызванный стимуляцией.
Класс IIb:
Нейромышечные заболевания, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с любой степенью фасцикулярной блокады, с симптоматикой или без, так как возможно непредвиденное ухудшение атриовентрикулярного проведения.
Класс III:
1. Фасцикулярная блокада без АВ-блокады и клинической симптоматики.
2. Асимптомная фасцикулярная блокада в сочетании с АВ-блокадой I степени.
Показания к постоянной электрокардиостимуляции при атриовентрикулярных блокадах при остром инфаркте миокарда
(ACC/AHA/NASPE, 2002)
При возникновении симптоматической брадикардии, обусловленной нарушением атриовентрикулярной проводимости в остром периоде инфаркта миокарда, некурабельной медикаментозно, показано проведение временной эндокардиальной электрокардиостимуляции. Данный вид электрокардиотерапии целесообразно использовать 12-14 дней. Согласно рекомендациям ACC/AHA по лечению пациентов с острым инфарктом миокарда, потребность во временной электрокардиостимуляции в острый период инфаркта миокарда сама по себе не определяет показаний к постоянной электрокардиостимуляции. По истечении вышеуказанного периода времени устанавливается степень нарушения АВ-проводимости, ее необратимость и определяются показания к проведению постоянной электрокардиотерапии.
Показания к постоянной электрокардиостимуляции у пациентов, перенесших инфаркт миокарда, осложненный нарушением атриовентрикулярной проводимости, в большей степени обусловлены нарушениями внутрижелудочковой проводимости. В отличие от показаний к постоянной электрокардиотерапии нарушений АВ-проводимости, критерии для отбора пациентов с инфарктом миокарда часто не зависят от наличия симптомной брадикардии. При рассмотрении показаний к постоянной электрокардиостимуляции у данной категории больных должны быть учтены тип нарушения атриовентрикулярной проводимости, локализация инфаркта миокарда и констатирована причинно-следственная связь указанных электрических нарушений с ним.
при приобретенных нарушениях атриовентрикулярной проводимости
после острого инфаркта миокарда (ACC/AHA/NASPE, 2002)
Класс I:
1. Персистирующая АВ-блокада II степени в системе ГисаПуркинье с билатеральной блокадой ножек пучка Гиса или АВ-блокада III степени на уровне или ниже системы Гиса-Пуркинье после острого инфаркта миокарда.
2. Транзиторная, далеко зашедшая (АВ-блокада II или III степени) инфранодальная АВ-блокада в сочетании с блокадой ножек пучка Гиса. Если уровень АВ-блокады неясен - показано проведение электрофизиологического исследования.
3. Персистирующая и симптомная АВ-блокада II или III степени.
Класс IIb:
1. Персистирующая АВ-блокада II или III степени на уровне атриовентрикулярного соединения.
Класс III:
1. Транзиторная АВ-блокада при отсутствии нарушений внутрижелудочковой проводимости.
2. Транзиторная АВ-блокада при изолированной блокаде передней ветви левой ножки пучка Гиса.
3. Появившаяся блокада передней ветви левой ножки пучка Гиса при отсутствии АВ-блокады.
4. Персистирующая АВ-блокада I степени при ранее имевшейся блокаде ножки пучка Гиса неизвестной давности.
5. Эхокардиография.
6. Тил т-тест.
8. Чреспищеводное электрофизиологическое исследование.
ИМПЛАНТИРУЕМЫЕ КАРДИОВЕРТЕРЫДЕФИБРИЛЛЯТОРЫ У ПАЦИЕНТОВ КАТЕГОРИИ ВЫСОКОГО РИСКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Имплантация кардиовертеров-дефибрилляторов
Технически процедура установки имплантируемого кардиовертера-дефибриллятора (ИКД) мало отличается от имплантации постоянных электрокардиостимуляторов. Перед операцией с помощью программатора оценивают состояние батареи устройства и функцию конденсатора, а антибрадикардитическую стимуляцию и функции ИКД-терапии отключают. После установки электродов в камерах сердца проводят их тестирование с помощью наружного стимулятора. В пекторальной области подкожно или субфасциально формируют ложе аппарата ИКД, который коммутируется с имплантированными электродами. С помощью программатора устанавливают параметры детекции и терапии. Затем проводится определение порога дефибрилляции и эффективность запрограммированного алгоритма ИКДтерапии. Для этого пациенту проводят кратковременный внутривенный наркоз и с помощью программатора индуцируют фибрилляцию желудочков (режимы T-shock (разряд дефибриллятора, синхронизированный с Т-волной) или 50 Hz burst-pacing)). При оптимально установленных параметрах терапии устройство должно нанести разряд и купировать фибрилляцию желудочков. Величина энергии разряда ИКД, устанавливаемая в устройстве, должна в 2 раза превышать величину порога дефибрилляции. При неэффективной терапии
ИКД неотложные мероприятия осуществляют с помощью наружного дефибриллятора.
Основы терапии кардиовертерами-дефибрилляторами
Современный ИКД представляет собой систему, состоящую из устройства, заключенного в небольшой титановый корпус, и одного или более электродов, установленных в камеры сердца. Аппарат содержит источник питания (литиево-серебряно-ваннадиевую батарею), преобразователь напряжения, резисторы, конденсатор, микропроцессор, системы анализа сердечного ритма и высвобождения разряда, а также базу данных электрограмм аритмических событий. В клинической практике используются желудочковые и предсердные электроды как с пассивным, так и с активным механизмами фиксации для проведения дефибрилляции, антитахикардической, антибрадикардической электрокардиостимуляции и ресинхронизирующей терапии. На сегодняшний день применяются одно-, двух- и трехкамерные (бивентрикулярные) системы. В большинстве систем само устройство, заключенное в титановый корпус, является частью цепи разряда дефибриллятора (рис. 2.8).
 Рис. 2.8.
Имплантируемый кардиовертер-дефибриллятор. Примечание.
(1)
титановый корпус, (2) внутрисердечный электрод. Цепь разряда
имплантируемого кардиовертера-дефибриллятора заключена между корпусом
устройства и катушкой (3), находящейся на электроде. С помощью
дистального кончика электрода (4) осуществляется детекция аритмических
событий и проведение антитахи- и антибрадистимуляции
Рис. 2.8.
Имплантируемый кардиовертер-дефибриллятор. Примечание.
(1)
титановый корпус, (2) внутрисердечный электрод. Цепь разряда
имплантируемого кардиовертера-дефибриллятора заключена между корпусом
устройства и катушкой (3), находящейся на электроде. С помощью
дистального кончика электрода (4) осуществляется детекция аритмических
событий и проведение антитахи- и антибрадистимуляции
Таблица 2.5
Режимы антитахикардитической стимуляции
 Функции имплантируемых кардиовертеров-дефибрилляторов
Функции имплантируемых кардиовертеров-дефибрилляторов
1. Антитахикардитическая стимуляция (АТС).
Режимы подавляющей желудочковой стимуляции в зоне детекции желудочковых тахикардий представлены в табл. 2.5.
2. Кардиоверсия - низковольтный шок (разряд высокой энергии постоянного электрического тока), который наносится вне уязвимой фазы сердечного цикла (через 20-30 мс после вершины зубца R) в зоне детекции желудочковой тахикардии (ЖТ).
3. Дефибрилляция - высоковольтный шок (разряд высокой энергии постоянного электрического тока) в зоне детекции высокочастотной ЖТ и фибрилляции желудочков (ФЖ).
4. Антибрадикардитическая стимуляция - электрокардиостимуляция в зоне детекции брадикардии.
В основе детекции аритмий лежит анализ R-R интервалов, форма желудочкового сигнала, стабильность R-R интервалов, соотношение характеристик предсердной и желудочковой активности (в двухкамерных системах). Входящий сигнал проходит фильтрацию, в результате которой элиминируются и не подвергаются детекции низкочастотные (обусловленные Т-волной) и высокочастотные компоненты (обусловленные активностью скелетной мускулатуры). Параметры детекции и алгоритмы терапии для каждой зоны устанавливаются интраоперационно во время тестирования устройства с помощью программатора (рис. 2.9). В зависимости от клинической ситуации проводимой медикаментозной терапии эти значения в дальнейшем могут корректироваться.
 Рис. 2.9.
Зоны детекции и возможные режимы работы кардиовертерадефибриллятора
Рис. 2.9.
Зоны детекции и возможные режимы работы кардиовертерадефибриллятора
Для предотвращения неоправданных разрядов во время суправентрикулярных аритмий, синусовой тахикардии применяются функции анализа стабильности R-R интервалов (при тахисистолической форме фибрилляции предсердий), морфологии желудочкового сигнала, регистрируемого желудочковым электродом, внезапности начала тахиаритмии (при возникновении ЖТ или ФЖ величина интервала R-R внезапно уменьшается), а также двухкамерная регистрация сигналов в предсердиях и желудочках. Алгоритм терапии подбирается врачом на основании переносимости больным клинической тахикардии. При ФЖ или быстрой ЖТ первым шагом в терапии является дефибрилляция, мощностью на 10 Дж превышающая интраоперационный порог дефибрилляции с последующим автоматическим нарастанием мощности разрядов до максимальных значений (30 Дж), а также изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот.
Профилактика внезапной сердечной смерти Определения
Внезапная сердечная смерть (ВСС) - смерть, развившаяся моментально или наступившая в течение часа с момента возникновения острых изменений в клиническом статусе пациента.
Сердечный арест - это состояние, сопровождающееся потерей сознания вследствие асистолии, желудочковой тахикардии или фибрилляции желудочков. Обязательным условием диагноза сердечного ареста является регистрация этих эпизодов электрокардиографическим методом.
Устойчивая желудочковая тахикардия - это тахикардия продолжительностью более 30 с.
Неустойчивая желудочковая тахикардия - это тахикардия от 3 комплексов до 30 с, которая самостоятельно прерывается.
Факторы риска - это клинические признаки, указывающие на вероятность развития ВСС у конкретного пациента в текущем году в процентах.
Профилактика внезапной сердечной смерти - это комплекс мероприятий, проводимых у лиц, переживших сердечный арест (вторичная профилактика), или у пациентов, имеющих высокий риск развития ВСС без эпизодов сердечного ареста в анамнезе (первичная).
Патофизиология внезапной сердечной смерти
Наиболее частыми электрофизиологическими механизмами развития ВСС являются желудочковая тахикардия и фибрилляция желудочков. Приблизительно в 20-30% случаев причинами ВСС являются брадиаритмия и асистолия. Часто довольно сложно определить первичный механизм ВСС у пациентов с документированной брадиаритмией, так как асистолия может быть следствием устойчивой ЖТ. С другой стороны, исходная брадиаритмия, обусловленная ишемией миокарда, может спровоцировать ЖТ или ФЖ. Ниже приводится этиология внезапной сердечной смерти по J. Ruskin (1998)
Ишемическая болезнь сердца Дилатационная кардиомиопатия Гипертрофия левого желудочка Гипертрофическая кардиомиопатия Приобретенные пороки сердца Врожденные пороки сердца Острый миокардит
Аритмогенная дисплазия правого желудочка
Аномалии развития коронарных артерий
Саркоидоз
Амилоидоз
Опухоли сердца
Дивертикулы левого желудочка
Синдром WPW
Синдром удлиненного интервала QT Лекарственная проаритмия Кокаиновая интоксикация Выраженный электролитный дисбаланс Идиопатическая желудочковая тахикардия
В большинстве случаев ВСС развивается у пациентов со структурной патологией миокарда. Пациенты с врожденными аритмическими синдромами при отсутствии морфологических изменений сердца составляют небольшой процент в структуре ВСС. На молеку-
Таблица 2.6
Эффективность терапии имплантируемыми кардиовертерами-дефибрилляторами
 Примечание.
ВСР
- вариабельность ритма сердца; ИБС - ишемическая болезнь сердца; ИМ -
инфаркт миокарда; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая
экстрасистолия; ХСН - хроническая сердечная недостаточность; ФВ -
фракция выброса; ЧСС - частота сердечных сокращений; эндо-ЭФИ -
эндокардиальное электрофизиологическое исследование; ФК - функциональный
класс
Примечание.
ВСР
- вариабельность ритма сердца; ИБС - ишемическая болезнь сердца; ИМ -
инфаркт миокарда; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая
экстрасистолия; ХСН - хроническая сердечная недостаточность; ФВ -
фракция выброса; ЧСС - частота сердечных сокращений; эндо-ЭФИ -
эндокардиальное электрофизиологическое исследование; ФК - функциональный
класс
лярном уровне причинами электрической нестабильности миокарда могут быть изменения концентрации ионов калия и кальция, нейрогормональные сдвиги, мутации, обусловливающие дисфункцию натриевых каналов, что приводит к повышенному автоматизму и формированию re-entry.
Отбор пациентов для имплантации кардиовертеров-дефибрилляторов
В 1984 г. J.T. Bigger провел анализ вероятностной характеристики развития ВСС в каждом клиническом случае. Он выделил группы лиц с высоким и умеренным факторами риска развития ВСС. Данные представлены в табл. 2.7.
Таблица 2.7
Факторы риска внезапной сердечной смерти
Примечание. ОИМ - острый инфаркт миокарда; ФВ - фракция выброса; ЖЭ - частая желудочковая экстрасистолия; ЖТ - желудочковая тахикардия; ВСС - внезапная сердечная смерть.
Важно отметить, что эти данные нашли свое отражение в исследовании AVID, которое было проведено 13 лет спустя после работы J.T. Bigger. Таким образом, наиболее значимыми предикторами ВСС являются: дисфункция левого желудочка, эпизод сердечного ареста в анамнезе, гипертрофия миокарда, а также ряд заболеваний, основу которых составляет наличие электрически нестабильного миокарда (см. табл. 2.6).
Класс I:
1. Лица, пережившие сердечный арест, произошедший вследствие ФЖ или ЖТ, которые были обусловлены не транзиторными и обратимыми причинами (AVID-пациенты).
2. Пациенты со спонтанной, устойчивой ЖТ, верифицированной на ЭКГ или при холтеровском мониторировании в сочетании со структурной патологией сердца.
3. Пациенты с синкопальными состояниями неустановленной этиологии и с выявленной, гемодинамически значимой, устойчивой ЖТ или ФЖ, индуцированной во время ЭФИ. При этом постоянная ААТ неэффективна, плохо переносима или сам пациент не желает ее получать.
4. Пациенты с ИБС, указанием на ОИМ в анамнезе и неустойчивой ЖТ при имеющейся умеренно сниженной ФВ левого желудочка (ниже 35%), а также индуцированной ФЖ или устойчивой ЖТ во время ЭФИ, которая не подавляется антиаритмическими препаратами Ia класса (MADIT I-пациенты).
5. Пациенты с ФВ левого желудочка ниже 30% как минимум по прошествии одного месяца после ОИМ и трех месяцев после операции реваскуляризации миокарда (MADIT II- и SCD-HF-пациенты).
6. Пациенты со спонтанной, устойчивой ЖТ, верифицированной на ЭКГ или при холтеровском мониторировании без структурной патологии сердца, и которая не устраняется другими методами лечения.
Класс II:
1. Пациенты с указаниями в анамнезе на перенесенную ФЖ, которым проведение ЭФИ противопоказано.
2. Пациенты с плохо переносимой, гемодинамически значимой устойчивой ЖТ в периоде ожидания трансплантации сердца.
3. Пациенты с наследственными или приобретенными заболеваниями, которые сопровождаются высоким риском развития сердечного ареста вследствие ФЖ или ЖТ (синдром удлиненного интервала QT, гипертрофическая кардиомиопатия, синдром Бругада, аритмогенная дисплазия правого желудочка).
4. Пациенты с синкопальными состояниями в сочетании с дисфункцией левого желудочка и индуцированной во время эндо-ЭФИ ЖТ при исключении других причин развития синкопального состояния.
5. Пациенты с распространенной структурной патологией сердца и синкопальными состояниями, у которых предыдущие исследования не дали определенного результата в установлении причины.
Класс III:
1. Пациенты без структурной патологии сердца и синкопальными состояниями неясной этиологии без выявленной ЖТ во время ЭФИ, и когда другие причины развития синкопе не исключены окончательно.
2. Пациенты с постоянно рецидивирующей ЖТ.
3. Пациенты с идиопатическими ЖТ, которые могут быть успешно элиминированы радиочастотной катетерной деструкцией (идиопатические ЖТ из области выходных трактов правого и левого желудочков, ЖТ с циркуляцией импульса по проводящей системе сердца (bundle branch re-entry) и др.
4. Пациенты с желудочковыми нарушениями ритма, возникающими вследствие транзиторных и обратимых причин (расстройства электролитного баланса, острые отравления, эндокринные нарушения, применение адреномиметиков и проч.).
5. Больные с выраженными психическими расстройствами, которые могут препятствовать наблюдению за больным в раннем и отдаленном послеоперационном периодах.
6. Пациенты с терминальными заболеваниями, у которых предполагаемый прогноз продолжительности жизни менее 6 мес.
7. Пациенты с ишемической болезнью сердца без индуцированной в ходе эндо-ЭФИ ЖТ, с дисфункцией левого желудочка, которым планируется проведение реваскуляризационных мероприятий.
8. Пациенты с IV функциональным классом сердечной недостаточности по NYHA, рефрактерной к медикаментозной терапии, и пациенты, которые не могут быть кандидатами на трансплантацию сердца.
Программа инструментального обследования пациентов
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Рентгенография органов грудной клетки.
5. Эхокардиография.
6. Тилт-тест.
7. УЗДГ брахиоцефальных артерий.
8. Коронарография.
9. Эндокардиальное электрофизиологическое исследование (при необходимости).
ИСПОЛЬЗОВАНИЕ РЕСИНХРОНИЗИРУЮЩЕЙ ЭЛЕКГРОКАРДИОТЕРАПИИ У ПАЦИЕНТОВ С ВЫСОКИМ ФУНКЦИОНАЛЬНЫМ КЛАССОМ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Имплантация кардиоресинхронизирующих устройств
За исключением установки электрода для стимуляции левого желудочка сердца методика имплантации кардиоресинхронизирующего устройства (КРСУ) мало чем отличается от хирургической техники имплантации двухкамерного ЭКС. На первом этапе имплантации КРСУ осуществляется установка предсердного и правожелудочкового эндокардиальных электродов (рис. 2.10, панель В). При имплантации желудочкового электрода с пассивным механизмом фиксации последний необходимо установить в области верхушки, ближе к межжелудочковой перегородке, таким образом, чтобы кончик электрода проецировался вблизи тени диафрагмы, что обеспечивает наилучшую фиксацию. Желудочковые электроды с активным механизмом фиксации можно позиционировать в области межжелудочковой перегородки или выходном тракте правого желудочка сердца.
Эндокардиальные J-образные предсердные электроды с пассивной фиксацией устанавливаются в ушке правого предсердия. При имплантации предсердных электродов с активным механизмом фиксации возможно их позиционирование как в ушке правого предсердия, так и в области межпредсердной перегородки.
На следующем этапе операции выполняют катетеризацию и контрастирование коронарного синуса (рис. 2.10, панель А). Наиболее выраженный клинический эффект бивентрикулярной стимуляции может быть достигнут при позиционировании левожелудочкового электрода в латеральной, переднелатеральной или заднелатеральной венах сердца (рис. 2.10, панель Б). Установка электрода в большой или средней вене сердца приводит к стимуляции переднего или

 Рис. 2.10.
Имплантация
электродов кардиоресинхронизирующего устройства. Панель А:
контрастирование коронарного синуса. Панель Б: имплантация
левожелудочкового электрода трансвенозным доступом через коронарный
синус в латеральную вену сердца. Панель В: схема расположения электродов
кардиоресинхронизирующего устройства
Рис. 2.10.
Имплантация
электродов кардиоресинхронизирующего устройства. Панель А:
контрастирование коронарного синуса. Панель Б: имплантация
левожелудочкового электрода трансвенозным доступом через коронарный
синус в латеральную вену сердца. Панель В: схема расположения электродов
кардиоресинхронизирующего устройства
верхушечного сегментов левого желудочка, что ассоциируется с увеличением степени митральной регургитации и, следовательно, сопровождается отрицательным гемодинамическим эффектом. Для проведения и установки левожелудочкового электрода в венозные сосуды системы коронарного синуса используют специальный набор инструментария - систему доставки электрода коронарного синуса.
Желудочковая десинхронизация как звено патогенеза хронической сердечной недостаточности
В основе синдрома хронической сердечной недостаточности (ХСН) лежит диастолическая и/или систолическая дисфункция
левого желудочка. ХСН характеризуется прогрессирующим течением и сопровождается процессом ремоделирования левого желудочка, который проявляется изменением геометрии камер сердца в виде их гипертрофии и/или дилатации. Возникающие механические нарушения в работе сердца как насоса способствуют поддержанию и прогрессированию процессов ремоделирования, а также сопровождаются сложными компенсаторными и патофизиологическими изменениями, включающими в себя в том числе нарушения фазовой структуры сердечного цикла (рис. 2.11).
 Рис. 2.11.
Нарушение фазовой структуры сердечного цикла. Примечание:
Панель
А: схематическое изображение нарушения фазовой структуры сердечного
цикла при блокаде левой ножки пучка Гиса. Обращает на себя внимание
увеличение периода предызгнания и уменьшение времени наполнения левого
желудочка. Панель Б: Нормализация фазовой структуры сердечного цикла в
результате проведения ресинхронизирующей терапии. Происходит
синхронизация систолы правого и левого желудочков, увеличение времени
наполнения левого желудочка и сокращение периода предызгнания
Рис. 2.11.
Нарушение фазовой структуры сердечного цикла. Примечание:
Панель
А: схематическое изображение нарушения фазовой структуры сердечного
цикла при блокаде левой ножки пучка Гиса. Обращает на себя внимание
увеличение периода предызгнания и уменьшение времени наполнения левого
желудочка. Панель Б: Нормализация фазовой структуры сердечного цикла в
результате проведения ресинхронизирующей терапии. Происходит
синхронизация систолы правого и левого желудочков, увеличение времени
наполнения левого желудочка и сокращение периода предызгнания
Нарушения внутрижелудочковой проводимости (в 90% случаев в форме блокады левой ножки пучка Гиса (БЛНПГ)) встречаются у 35% пациентов с ХСН. При этом имеется прямая корреляция между длительностью комплекса QRS и смертностью среди этой группы пациентов с ХСН (рис. 2.12).

Рис. 2.12. Выживаемость среди пациентов с хронической сердечной недостаточностью в зависимости от длительности желудочкового комплекса
Нарушения проведения по ножкам системы Гиса-Пуркинье приводят к механической меж- и внутрижелудочковой десинхронизации. Наиболее ярко это выражено при БЛНПГ. В этом случае происходит чередование активного сокращения и пассивного растяжения контралатеральных областей левого желудочка: ранне-систолическое сокращение межжелудочковой перегородки с растяжением боковой стенки левого желудочка и последующее поздне-систолическое сокращение латеральной стенки с выраженным конечно-систолическим перерастяжением межжелудочковой перегородки. В результате происходит пассивное смещение межжелудочковой перегородки в сторону правого желудочка, ошибочно называемое «парадоксальным». Существующая последовательность деполяризации миокарда левого желудочка ведет к уменьшению длительности фазы быстрого наполнения левого желудочка, задержке сокращения левого желудочка и замедлению общей продолжительности систолического выброса из него, уменьшению времени диастолического расслабления и наполнения левого желудочка, увеличению периода предыз-
гнания (см. рис. 2.11). Изменения фаз сердечного цикла в условиях десинхронизации приводят к увеличению конечно-систолического и конечно-диастолического давлений в полостях сердца, уменьшению фракции изгнания и фракции укорочения волокон левого желудочка, повышению давления в легочной артерии, являясь отражением прогрессирования систолической и диастолической дисфункции у пациентов с ХСН.
Появление патологической митральной регургитации у пациентов с ХСН служит неблагоприятным прогностическим признаком. Значительный вклад в ее формирование вносят наличие подклапанной дисфункции левого желудочка, дискоординации движения групп папиллярных мышц и перерастяжение фиброзного кольца. При наличии БЛНПГ раннее активное движение межжелудочковой перегородки, возникающее до закрытия створок митрального клапана, также ведет к появлению нечеткости границы между диастолой и систолой, что может усиливать степень митральной регургитации.
Патологическое систолическое растяжение поперечных мышечных мостиков левого желудочка создает условия для поддержания re-entry и увеличивает вероятность появления жизнеугрожающих желудочковых нарушений ритма сердца.
Представленные механизмы десинхронизации у пациентов с ХСН снижают эффективность сократительной функции сердца и сопровождаются повышением энергозатрат, что ухудшает его функциональное состояние независимо от этиологического фактора сердечной недостаточности.
Десинхронизация складывается из нескольких компонентов: предсердно-желудочкового, межжелудочкового и внутрижелудочкового.
Первый компонент отражает разобщение координации систолы предсердий и желудочков. В клинической практике для верификации предсердно-желудочковой десинхронизации используется оценка трансмитрального потока допплеровским методом при выполнении трансторакальной эхокардиографии (Эхо-КГ). Слияние пиков Е (пассивное диастолическое наполнение предсердий) и А (систола предсердий) иллюстрирует предсердно-желудочковую десинхронизацию (рис. 2.13).
Показателями межжелудочковой десинхронизации являются длительность комплекса QRS более 120 мс, задержка движения латеральной стенки левого желудочка относительно движения межжелудочковой перегородки более 140 мс, регистрируемая во время
 Рис. 2.13.
Определение
трансмитрального кровотока допплеровским методом у пациента с
имплантированным КРСУ и установленной величиной АВ-задержки 140 мс.
Рис. 2.13.
Определение
трансмитрального кровотока допплеровским методом у пациента с
имплантированным КРСУ и установленной величиной АВ-задержки 140 мс.
Примечание. В левой части рисунка потоки Е и А, характеризующие пассивное диастолическое наполнение и предсердную систолу, неразличимы. В правой части рисунка представлены данные допплерографии у того же пациента при изменении величины АВ-задержки (было установлено 110 мс). Отмечается расхождение пиков Е (первый, низкоамплитудный) и А (второй, высокоамплитудный), свидетельствующих об оптимизации диастолического наполнения
проведения Эхо-КГ в М-режиме, увеличение показателя кумулятивной асинхронии более 100 мс при проведении тканевого допплеровского сканирования, разница интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии, превышающая 40 мс (рис. 2.14, 2.15, см. на вклейке).
Внутрижелудочковая десинхронизация может быть верифицирована методом тканевой допплерографии. Использование различных режимов тканевой допплерографии позволяет отразить задержку между началом комплекса QRS на поверхностной ЭКГ и появлением тканевого допплеровского сигнала, отображающего систолическую волну в соответствующих сегментах миокарда левого желудочка (рис. 2.16, см. на вклейке).
Внутрижелудочковая десинхронизация является независимым предиктором неблагоприятного течения сердечно-сосудистых заболеваний у пациентов, перенесших инфаркт миокарда.
 Рис. 2.14.
Признаки межжелудочковой десинхронизации. Примечание.
М-режим
трансторакальной эхокардиографии: верифицируется задержанное сокращение
латеральной стенки левого желудочка относительно межжелудочковой
перегородки у пациента с блокадой левой ножки пучка Гиса
Рис. 2.14.
Признаки межжелудочковой десинхронизации. Примечание.
М-режим
трансторакальной эхокардиографии: верифицируется задержанное сокращение
латеральной стенки левого желудочка относительно межжелудочковой
перегородки у пациента с блокадой левой ножки пучка Гиса
Таблица 2.8
Клинические эффекты ресинхронизирующей терапии
 Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции
Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции
Порядок тестирования КРСУ мало отличается от тестирования обычного электрокардиостимулятора. Дополнительно в ходе проверки КРСУ проводят определение параметров, относящихся к левожелудочковому электроду (порог электрокардиостимуляции, импеданс). В устройствах, не обладающих функцией отдельного программирования левожелудочкового канала электрокардиостимуляции, в ходе определения порога стимуляции целесообразно мониторирование ЭКГ в 12 отведениях. Если во время данного теста происходит изменение морфологии стимулированного желудочкового комплекса на поверхностной ЭКГ при сохраняющемся желудочковом захвате, то это свидетельствует о том, что достигнут порог стимуляции в одном из желудочковых каналов. При этом желудочковые «захваты» осуществляются благодаря более низкой величине порога стимуляции во втором желудочковом канале. На основании анализа 12 отведений ЭКГ можно определить, какой режим стимуляции используется у пациента (табл. 2.9 и рис. 2.17, см. на вклейке).
Таблица 2.9
Морфология комплекса QRS в отведениях I, III и V 1 при проведении различных видов электрокардиостимуляции
 Пациенты с синусовым ритмом
Пациенты с синусовым ритмом
При отсутствии у пациента с имплантированным КРСУ хронической фибрилляции предсердий важным моментом является оптимизация предсердно-желудочковой ресинхронизации методом под-
бора оптимальных параметров АВ-задержки. Существуют несколько методик определения этой величины. Наиболее часто используется формула Риттера, которая позволяет вычислить оптимальную величину АВ-задержки на основании регистрации формы трансмитрального потока, регистрируемого в М-режиме при трансторакальной эхокардиографии:
ABопт. - ABдл. + QAдл. - QA.коротк.
АВ дл - величина устанавливается на программаторе и составляет 75% от интервала PQ.
АВ коротк - величина устанавливается на программаторе и составляет 25% от интервала PQ.
QA дл - измеряется от начала стимуляционного желудочкового комплекса (Q) до конца пика А при запрограммированной удлиненной АВ-задержке (АВ дл.).
QА кOрOTK - измеряется от начала стимуляционного желудочкового комплекса (Q) до конца пика А при запрограммированной короткой АВ-задержке (АВ коротк).
В ряде случаев АВ-задержка программируется на основании визуальной регистрации оптимальной формы пиков трансмитрального потока (рис. 2.13). Особо подчеркнем, что величина программируемой АВ-задержки должна быть меньше величины интервала PQ, так как только в этом случае будет обеспечиваться постоянная бивентрикулярная стимуляция.
Оптимизация параметров межжелудочковой ресинхронизации возможна только в аппаратах, обладающих функцией отдельного программирования лево- и правожелудочкового каналов. Установка величины межжелудочковой задержки в диапазоне 5-20 мс с левожелудочковым опережением является оптимальной в гемодинамическом отношении, по сравнению с одновременной право- и левожелудочковой стимуляцией. При этом целесообразно проводить подбор величины межжелудочковой задержки под эхокардиографическим контролем методом вычисления разницы интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии (не более 40 мс) и задержки движения латеральной стенки левого желудочка относительно межжелудочковой перегородки (не более 40 мс).
Пациенты с хронической формой фибрилляции предсердий
В этой категории пациентов подбор АВ-задержки невозможен, так как систола предсердий отсутствует как таковая. Поэтому ключевым моментом является достижение постоянной бивентрикулярной стимуляции за счет установки частоты ЭКС не ниже 70-80 в минуту и контроля частоты желудочковых сокращений. Нормосистолия достигается либо медикаментозным подавлением АВ-проведения, либо проведением модификации атриовентрикулярного соединения методом радиочастотной деструкции. Принципы оптимизации межжелудочковой ресинхронизации не отличаются от тех, которые применимы в отношении пациентов с синусовым ритмом.
По данным клинических исследований, установлено, что приблизительно у 25-30% пациентов с высоким функциональным классом ХСН не отмечается положительного эффекта от проведения кардиоресинхронизации по ряду причин. Во-первых, это отсутствие выраженных признаков десинхронизации правого и левого желудочков до имплантации системы. Во-вторых, неадекватное позиционирование электрода для левожелудочковой стимуляции. Электростимуляция латеральной стенки левого желудочка более эффективна через электрод, проведенный в латеральную или заднелатеральную вены сердца. В то же время электростимуляция из сердца или большой вены сердца часто не оказывает положительного влияния на систолическую функцию левого желудочка. В-третьих, некорректная установка параметров кардиоресинхронизации. Улучшение клинической симптоматики возникает только при условии постоянной бивентрикулярной стимуляции.
Показания к имплантации кардиоресинхронизирующих устройств (ЕСС/ACC/AHA, 2005)
Класс I:
1. Сердечная недостаточность III/IV ФК (NYHA), несмотря на оптимальную медикаментозную терапию.
2. Длительность комплекса QRS >130 мс.
3. Фракция выброса левого желудочка <35%.
4. Конечно-диастоличсекий размер левого желудочка >55 мм.
5. Эхокардиографические признаки желудочковой десинхронизации.
Программа инструментального обследования пациентов
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Тест с 6-минутной ходьбой.
5. Рентгенография органов грудной клетки.
6. Эхокардиография.
7. Коронарография.
Имплантация электрокардиостимулятора (ЭКС ) является методом выбора при лечении больных с опасными для жизни нарушениями ритма сердца, проявляющимися резко выраженной брадикардией
Электрокардиостимулятор (ЭКС ) с однокамерной желудочковой стимуляцией (VVI) работают в режиме «demand», т.е. включаются «по требованию», когда частота сокращений желудочков снижается ниже определенного порогового уровня.
На ЭКГ при VVI вначале появляется спайк ЭКС, за которым следует уширенный деформированный желудочковый комплекс QRS. По конфигурации он напоминает блокаду ЛНПГ, так как электрод ЭКС расположен в ПЖ. Отмечается вторичное нарушение реполяризации.
При двухкамерной стимуляции (режим DDD) создаются физиологические условия для сердечной деятельности. Основным показанием к имплантации двухкамерного ЭКС является АВ-блокада при сохранной функции синусового узла.
На ЭКГ при двухкамерной стимуляции сначала появляется спайк предсердного импульса ЭКС, после которого регистрируется маленький зубец Р. Через определенный запрограммированный интервал следует спайк желудочкового импульса ЭКС, вызывающего появление уширенного комплекса QRS, напоминающего блокаду ЛНПГ, далее отмечается депрессия сегмента ST и отрицательный зубец Т.
Однокамерная желудочковая стимуляция в режиме «demand» («по требованию») получила широкое распространение в мире. Она может проводиться с адаптацией по частоте или без таковой (режимы VVI-R или VVI соответственно). Частота осложнений метода низкая. Основным показанием является тяжелая брадиаритмия, например мерцание предсердий. Единственный электрод располагается в ПЖ и служит как для детекции, так и для стимуляции.
ЭКС в соответствии с запрограммированными условиями посылает импульсы к желудочку только «по требованию», т.е. при снижении ЧСС ниже определенного порога значения. Если ЧСС превышает пороговое значение, то благодаря сенсорной функции электрода активность ЭКС подавляется.
На ЭКГ
, зарегистрированной на фоне работы ЭКС, регистрируется совершенно иная картина по сравнению с той, которая была представлена в в отдельных статьях на сайте. Тем не менее распознать эту ЭКГ нетрудно, так как изменения, которые на ней появляются, довольно характерны.
ЭКГ
при различных типах электрокардиостимуляции показаны на рисунке ниже в конце статьи.
После имплантации ЭКС , работающего «по требованию», претерпевает существенные изменения. Сердечному комплексу предшествует спайк ЭКС, после которого следует желудочковый комплекс QRS, который уширен и деформирован и напоминает блокаду ЛНПГ. Причина такой конфигурации QRS состоит в том, что стимулирующий электрод располагается в ПЖ, который поэтому сокращается раньше левого, в который возбуждение приходит необычным путем.
На ЭКГ , регистрируемой у больных с функционирующим ЭКС, всегда отмечаются признаки нарушения реполяризации миокарда в виде депрессии сегмента ST и отрицательного зубца Т.
После имплантации ЭКС нарушение реполяризации часто можно выявить и при собственном ритме. Так, в левых грудных отведениях V5 и V6 регистрируется глубокий остроконечный отрицательный зубец Т, которого раньше не было. Эти изменения, по-видимому, связаны с локальной ирритацией миокарда.
 ЭКГ при нормальной работе ЭКС (режим VVI)
.
ЭКГ при нормальной работе ЭКС (режим VVI)
.
После спайка ЭКС следует желудочковый комплекс, напоминающий блокаду ЛНПГ.
 Неэффективная функция электрокардиостимулятора (ЭКС)
.
Неэффективная функция электрокардиостимулятора (ЭКС)
.
Состояние после имплантации ЭКС, работающего в режиме VVI. Частота импульсации ЭКС 73 в минуту.
После спайка ЭКС желудочковый комплекс появляется нерегулярно. Случайное появление сочетанных комплексов (К).
Дислокация электрода. При рентгеноскопии электрод оказался в легочной артерии.
Осложнения после имплантации ЭКС для желудочковой стимуляции «по требованию», как уже говорилось, наблюдаются редко. К ним относятся преждевременное истощение элемента электропитания ЭКС, нарушение функции детекции, дислокация электрода и его перелом, а также инфицирование ложа ЭКС. В связи с этим за больными необходимо регулярное наблюдение.
Синдром электрокардиостимулятора после имплантации электрокардиостимулятора (ЭКС)
Синдром ЭКС является редким осложнением после имплантации ЭКС , работающего в режиме VVI, и связан с сохранением синусового ритма. При желудочковой стимуляции иногда возможна деполяризация предсердий вследствие ретроградного проведения возбуждения по АВ-узлу. Если сокращение предсердий происходит при закрытых атриовентрикулярных клапанах, то давление в предсердиях внезапно резко повышается. Больные в таких случаях жалуются на сердцебиение, головокружение и обмороки.
Это осложнение является показанием к имплантации ЭКС для двухкамерной имплантации (режим DDD); в качестве альтернативы можно уменьшить частоту стимуляции желудочков.
Особенности ЭКГ при электрокардиостимуляции
:
Имплантация ЭКГ - метод выбора при резко выраженной брадикардии
Желудочковая стимуляция «по требованию» (VVI) - часто применяемый простой способ электрокардиостимуляции
ЭКГ: после появления спайка ЭКС следует комплекс QRS, напоминающий по конфигурации блокаду ЛНПГ
Двухкамерная стимуляция (DDD) - современный способ электрокардиостимуляции
ЭКГ: после спайков ЭКС появляются соответственно зубец Р и атипичный комплекс QRS

Учебное видео расшифровки ЭКГ при кардиостимуляторе (искусственном водителе ритма)
При проблемах с просмотром скачайте видео со страницыДля лечения сердечных блокад электроды устанавливаются в правое предсердие или правый желудочек, либо в обе полости (рис.3,4).
 рис.3
(электрод в полости правого желудочка).
рис.3
(электрод в полости правого желудочка).
 рис.4
(электроды в полости правого предсердия и правого желудочка).
рис.4
(электроды в полости правого предсердия и правого желудочка).
Предсердный электрод фиксируют обычно к межпредсердной перегородке, желудочковый - к верхушке правого желудочка. Подобный вариант фиксации, возможно, не является оптимальным с точки зрения распространения электрического возбуждения и сокращения камер сердца, однако механическое крепление электродов (что крайне важно) получается максимально надежным. При имплантации ИПК с функцией кардиовертера-дефибриллятора локализация желудочкового электрода будет такой же .
При ресинхронизирующей терапии расположение "правых" электродов то же; в левый желудочек электрод проводится через расположенный в правом предсердии коронарный синус (устье венозной системы левого желудочка), далее по системе вен электрод доводится до оптимального (с точки зрения кардиостимуляции) места левого желудочка и фиксируется (рис.5).
 рис.5
(электроды в обоих желудочках и в правом предсердии).
рис.5
(электроды в обоих желудочках и в правом предсердии).
Что касается фиксирующих элементов электродов, то они бывают пассивные (усики) и активные ("как штопор для бутылки"); последние вкручиваются в эндокард (рис.6,7).
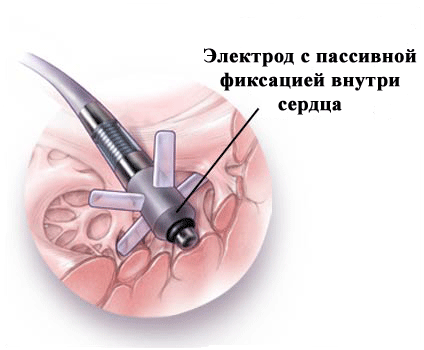 рис.6.
рис.6.
 рис.7.
рис.7.
Чтобы понять, как работают ИПК рассмотрим конкретные примеры. На рис. 8 представлена ЭКГ больной, страдавшей необъяснимыми обмороками . После проведения Холтеровского мониторирования ЭКГ причина синокопов была установлена - спорадически возникающие блокады сердца.

Ей имплантировали кардиостимулятор, после чего обмороки прекратились. На рис.9 запечатлен ЭКГ-фрагмент этой же пациентки в момент срабатывания кардиостимулятора "по требованию".

Еще один фрагмент ЭКГ (рис.10) больной, страдавшей до имплантации кардиостимулятора обмороками.

В настоящее время все кардиостимуляторы программируются в режиме "подстраховки" (по требованию, Demand ). То есть кардиостимулятор включается только в момент появления сердечной паузы определенной продолжительности, а приоритетными (для самого кардиостимулятора) являются собственные сокращения сердца, которые гораздо выгоднее для внутрисердечной гемодинамики (Что лучше: естественное распространение импульса или из верхушки правого желудочка? Ответ очевиден). Другое дело, что собственная сердечная проводимость может быть настолько угнетена (тотальные или субтотальные сердечные блокады), что почти все время работа сердца будет подчинена кардиостимулятору. Кроме того, полная зависимость от кардиостимулятора наблюдается в случае целенаправленной абляции какого-то критического участка проводящей системы (например, абляция АВ-узла при тахисистолической фибрилляции предсердий), что приводит к абсолютной невозможности естественного распространения электрического импульса.
Срабатывание кардиовертера-дефибриллятора происходит в момент возникновения желудочковой тахикардии (сокращение желудочков с немотивированно высокой частотой) или фибрилляции желудочков ("сердечный хаос", клиническая смерть). Данные аритмии обусловлены циркуляцией в желудочке одной или нескольких электрических волн. Кардиовертер-дефибриллятор купирует возникшую тахиаритмию 2-мя возможными путями: пачкой импульсов (по 8-10) с частотой превышающей частоту тахикардии (один из импульсов проникает в циркулирующую электрическую петлю и обрывает ее), либо одиночным разрядом электрического тока высокого напряжения (рис.11, 12).
 рис.11.
рис.11.
 рис.12.
рис.12.
Показанием для выполнения ресинхронизирующей терапии является обязательное сочетание тяжелой ХСН с ЭКГ-картиной полной блокады левой ножки пучка Гиса. Чем выраженнее блокада, тем выше вероятность положительного клинического эффекта от ресинхронизирующей терапии. На рис.13 запечатлен момент включения ресинхронизирующей терапии: до ее включения регистрируется блокада левой ножки (ширина комплекса 150 мс), в момент включения - блокада исчезает (ширина комплекса 100 мс), что отражает появившийся синхронизм в сокращении правого и левого желудочка.

Имплантация современных кардиостимуляторов приводит к минимальным ограничениям в жизни больного. При сохранении насосной функции сердца пациент с кардиостимулятором может вести обычный образ жизни: дача, любые домашние дела, работа, занятия физкультурой, путешествия, вождение автомобиля и т.д. Те ограничения, которые существовали раннее (запрет на использование больными различных электронных приборов), были обусловлены использованием монополярных систем кардиостимуляции. В таком случае при контакте с источниками высокого напряжения развивалось явление интермагнитной интерференции, что приводило к некорректной работе кардиостимулятора. Моно полярная и биполярная конфигурация устройства определяет разность потенциалов между двумя полюсами электродов ; при моно полярной чувствительности вторым полюсом электрода является корпус кардиостимулятора . Поэтому при моно полярном варианте из-за большого межэлектродного расстояния, равного 30-50 см, ЭКС может воспринимать все сигналы, попадающие в эти пределы (сокращения скелетных мышц, электрическую активность других сердечных камер и т.д.), тогда как при биполярном варианте конфигурации анод и катод находятся на конце электрода (расстояние между ними: 1-2 см) - в таком случае посторонние электрические сигналы не воспринимаются.

В настоящее время используют биполярные системы стимуляции, которые практически исключают проявление интермагнитной интерференции, а сами ИПК исправно работают даже после наружной дефибрилляции. Ограничения сохраняются лишь на профессиональную деятельность, которая связана с постоянным контактированием с источниками высокого напряжения (электроподстанции, электрощитовые, электромонтажные работы, сварка, отбойный молоток). Единственным абсолютным противопоказанием для больных с кардиостимулятором является проведением магнитно-резонансной томографии и прямое прикладывание магнита к подшитому аппарату. Некоторые зарубежные производители кардиостимуляторов вводят в эксплуатацию ИПК, допускающие возможность проведения МРТ. Однако пока безопасность проведение данной диагностики не будет доказан в рандомизированном исследовании выполнение МРТ больным с кардиостимулятором останется под запретом. Основой нормальной жизни пациента с кардиостимулятором являются плановые проверки системы у специалиста программирующего ИПК. Эквивалентом таких проверок может стать регулярное (раз в 6-12 месяцев) Холтеровское мониторирование ЭКГ , позволяющее вовремя выявить неполадки в работе кардиостимулятора. Впрочем, визитов к аритмологу все равно не избежать, хотя бы для того чтобы знать примерный срок службы батарейки ИПК и время ее плановой замены.
Кардиостимуляция осуществляется в режиме "по требованию". При корректной программации аппарата приоритет отдается собственным сокращениям сердца.
Современная кардиостимуляция не мыслима без функция частотной адаптации ().
Залогом надежного функционирования ЭКС является регулярная (раз в 6-12 месяцев) оценка эффективности его работы с помощью суточного мониторирования ЭКГ ; она позволит подтвердить правильность выбора режима стимуляции и своевременно выявить .
Каждому пациенту с ИПК выдается на руки так называемый паспорт кардиостимулятора. Его можно сравнить с инструкцией к применению какого-нибудь электроприбора. В данном документе указывается вся важнейшая информация, касающаяся параметров работы устройства: начиная от локализации электродов, заканчивая тонкими электрофизиологическим параметрами кардиостимуляции. Казалось бы, что пациенту до этого: он доверился врачу, который все сделал как надо. Так собственно и считает абсолютное большинство больных. Впрочем, всегда находится небольшой процент субъектов с кардиостимуляторами из категории "хочу все знать"; либо связывающие свое плохое самочувствие с "некорректно настроенными параметрами стимуляции" (так они сами считают), что заставляет их проводить время в "поисках истины".
После плановой проверки кардиостимулятора хирургом-аритмологом больному на руки выдается краткое заключение, отражающее текущие параметры кардиостимуляции (что было - что изменено); по сути данное заключение является упрощенным эквивалентом паспорта кардиостимулятора. При утере последнего такие заключения являются единственным источником информации о текущих настройках кардиостимулятора. Вне зависимости от того, что у пациента есть на руках (паспорт или заключение после плановой проверки устройства), при изучении данной документации можно увидеть разнообразные русскоязычные или англоязычные (в зависимости от страны производителя кардиостимулятора) специфические термины или, того хуже, непонятную аббревиатуру. Что-то типа:
Разберем наиболее важные понятия.
Режим (Mode) - отражает базовые характеристики кардиостимулятора. Представлен в виде последовательности заглавных английских букв; как правило 3-4-х, например: например DDDR . Что под ними скрывается?
Первая буква означает, какая камера стимулируется (то есть, где находится стимулирующий электрод): в предсердии (А - atrium) , в желудочке (V - ventricle) или в обеих камерах (D - dual).
Вторая буква означает, информация об электрической активности какой камеры сердца передается в кардиостимулятор (функция детекции / распознавания / восприятия). Другими словами, какая камера детектируется стимулятором: предсердие (А - atrium) , желудочек (V - ventricle) или обе камеры (D - dual).
Третья буква означает, разновидность реакции кардиостимулятора на полученную информацию от детектирующего электрода: I - inhibited (запрещение), T - triggered (стимуляция), D - dual (двойной ответ), возможны сочетания запрещающей и стимулирующей реакции.
Четвертая буква, если есть, обозначает наличие функции частотной стимуляции сердца (R - Rate modulation ) - способность кардиостимулятора выдавать импульсацию не с фиксированной частотой, а согласно потребностям организма (разгонять частоту сердечных сокращений).
Пятая буква, если есть, обозначает наличие функции кардиовертера-дефибриллятора: P (Pase - антитахикардитическая стимуляция), S (shock - дефибрилляция, шок) или D (P+S).
Если говорить, о самом сейчас распространенном режиме кардиоc тимуляции DDDR , то анализируя данную аббревиатуру, мы можем сказать следующее: "В обеих камерах сердца находится стимулирующий электрод (D - dual , обе) - то есть стимулируются и предсердия и желудочки; детектируется (воспринимается) информация об электрической активности обеих (D - dual) камер сердца; в зависимости от полученной информации от детектирующих электродов, кардиостимулятор может запретить себе выдавать стимуляцию (и продолжить следить за электрической активностью сердца) или осуществить стимуляцию (D - dual , оба ответа); кардиостимулятор имеет функцию частотной адаптации (R )".
Для полноценного понимания написанного, рассмотрим еще один режим стимуляции, широко используемый при брадикардитической фибрилляции предсердий - VVI . Анализируя данную аббревиатуру, мы можем сказать следующее: "Стимулирующий электрод находится в желудочке (V - ventricle ); воспринимающий электрод находится в желудочке (V - ventricle ); если стимулятор улавливает собственное сокращение желудочков, он не выдает импульс (I - inhibited , запрещение), отдавая тем самым приоритет спонтанной (естественной) электрической активности желудочков".
Таким образом, кардиостимулятор может быть однокамерным (электрод в одной камере, например VVI ) или двухкамерным (в обеих камерах по электроду, например DDDR ).
Важная ремарка: в одной сердечной камере может быть только один электрод; в зависимости от режима этот электрод выполняет или стимуляцию, или детекцию, или и то, и другое.
Базовая частота стимуляции (Base Rate, Lower Rate, Basic Rate) - частота, с которой осуществляется стимуляция сердца при отсутствии собственных сокращений. Как правило, программируется на значение 55 или 60 ударов в минуту.
Во-вторых, от общего процента желудочковой стимуляции - чем чаще желудочки сокращаются от стимулятора, тем выше риск развития синдрома кардиостимулятора. Именно для этого используют различные алгоритмы уменьшающие общий процент навязанных сокращений или уменьшают базовую частоту стимуляции - все, чтобы сердце как можно чаще сокращалось естественным образом, а ЭКС срабатывал лишь в редких эпизодах на подстраховке (Demand ).
В третьих, если в работе стимулятора не используется алгоритм . Если его нет - риск развития синдрома кардиостимулятора крайне высок.
В четвертых, если запрограммирована длительная (300-350 мс).
В-пятых, от длительности кардиостимуляции: даже при абсолютно корректной настройке ЭКС (например, режим DDDR ) никто не даст гарантии, что с годами у пациента не разовьется синдром кардиостимулятора.
Манифестировавший пейсмекерный синдром фактически представляет собой симптомокомплекс сердечной недостаточности, вызванный длительной кардиостимуляцией. Его проявления: слабость, отеки ног, быстрая утомляемость, головокружения, лабильность АД, одышка при минимальной нагрузке, тенденция к низкому АД.
Имплантированный в камеры сердца электрод кардиостимулятора чужероден для среды, в которой оказался. При проведении электрода в правый желудочек он неизбежно соприкасается со створками трикуспидального клапана, и этот контакт сохраняется все время нахождения электрода в сердце. В месте соприкосновения створки клапана и электрода возникает асептическое воспаление, которое приводит к необратимой деформации створки и развитию недостаточности трикуспидального клапана. Однако выраженность электрод-индуцированной трикуспидальной недостаточности может быть абсолютно разной: от незначительной или умеренной (часто), до тяжелой (редко). Важно понимать, что изначально невозможно предугадать, насколько тяжелой будет недостаточность клапана при имплантированном электроде. Однозначно утверждать можно лишь одно: она (клапанная регургитация) будет у каждого пациента. К счастью, практический опыт показывает, что электрод-индуцированная трикуспидальная недостаточность редко достигает тяжелой степени и мало сказывается на гемодинамике. Если же все-таки она достигла тяжелой степени, то это будет сопровождаться характерными симптомами сердечной недостаточности (слабость, одышка, отеки ног). Любая степень электрод-индуцированной трикуспидальной недостаточности не является показанием для замены (реимплантации) электрода.

Почему важно понимать, как работает кардиостимулятор сердца? Ответ на вопрос, во многом зависит как раз от конструкции и режима работы ЭКС. Прибор работает по следующей схеме (принципу):
- отслеживает ритм сердца, и если возникает редкий или неправильный ритм с пропуском сокращений, посылает через электрод импульс к сердцу;
- если ритм нормальный, ЭКС находится в состоянии покоя – у разных людей аппарат работает по-разному: у кого-то постоянно, у кого-то выключается;
- посылает импульс к предсердию и правому желудочку, – правому и левому желудочку, правому предсердию;
- частотно-адаптивные стимуляторы (R-типа) имеют сенсорные датчики, которые реагируют на изменения в организме (повышение температуры, активность нервной системы, физическую активность и т.д.), и согласно программе выбирают режим работы;
- от прибора и несет обратно информацию от сердца к микрочипу ЭКС.
Принцип работы электрокардиостимуляторов примерно одинаков – и неплохо раскрывается на следующих видео:
Некоторые модели стимуляторов оснащены устройствами записи режимов работы сердца. Врачи могут ознакомиться с этими записями при плановом контроле настроек ИВР. Однако такие аппараты, как правило, на одном заряде батареи работают меньше (т.к. заряд расходуется и на обеспечение энергией записывающих функций). Прибор регистрирует желудочковые и предсердные нарушения ритма сердца: мерцание и трепетание предсертий, желудочковые и наджелудочковые тахикардии, фибрилляции желудочков.
Как работает кардиостимулятор: постоянно или выключается – нужно узнавать непосредственно у лечащего врача. По факту, первое время это будет даже ощущаться – особо хорошо при лежании на левом боку (или на правом – если ЭКС имплантирован с правой стороны): ощущение гудения. Проходит достаточно быстро – через месяц-другой уже совершенно не будет чувствоваться (хотя может проявляться вновь и вновь, например, после физической активности – у меня было после заплыва на 800 – 1000 м).
С каждым годом в мире наблюдается всё большее увеличение первичных имплантаций антиаритмических устройств. В России тоже имеется такая тенденция, растёт и число пациентов с электрокардиостимуляцией (ЭКС) в практике врачей функциональной диагностики. Помимо поверхностной ЭКГ покоя таким пациентам проводится и суточное холтеровское мониторирование. Однако необходимо учесть, что трактовка результатов суточного мониторирования электрокардиографии (СМЭКГ), полученных у больных с кардиостимуляторами, имеет некоторые особенности и ограничения.
Для правильной интерпретации результатов исследования врачу необходимо иметь информацию о работе антиаритмического устройства пациента: тип кардиостимулятора, режим стимуляции, запрограммированную конфигурацию полярности стимулов (би- или монополярный), значения минимальной и максимальной частоты работы ЭКС, наименование различных алгоритмов, которые в момент записи СМЭКГ находятся в активном состоянии.
За пределами РФ пациенты перед исследованием предоставляют индивидуальную карту пейсмекера, что облегчает врачу задачу. В нашей же стране, к сожалению, не развита организационная система работы с пациентами, имеющими ЭКС, и нам приходится в лучшем случае довольствоваться обычной ЭКГ покоя, а порой нет и её. Кроме того, далеко не все системы регистрации снабжены выделенным каналом ЭКС, который очень помогает в работе. А ведь иногда при биполярной стимуляции амплитуда импульса (спайка) бывает настолько низкой, что на поверхностной ЭКГ он не виден.
Остановлюсь на показаниях к СМЭКГ у больных с кардиостимуляторами, принятых за рубежом. В России пока не разработаны национальные рекомендации по этому поводу, но работа над этим ведётся. Показания разделены на три класса.
К первому классу относятся состояния, в отношении которых все эксперты согласны, что СМЭКГ предоставляет полезную и важную для лечения пациента информацию: частые симптомы сердцебиения, синкопальные и пресинкопальные состояния для установления их причины, а также для оказания помощи в программировании усовершенствованных функций устройства, таких как алгоритмы «частотная адаптация и автоматическое переключение режима стимуляции»; выявление подозреваемой неисправности компонентов системы стимуляции, когда тестирование устройства не позволяет поставить окончательный диагноз; оценка эффективности сопутствующей медикаментозной терапии у пациентов с частым срабатыванием кардиовертера-дефибриллятора.
Ко второму классу относятся состояния, при которых СМЭКГ применяется, но ценность получаемой информации не так очевидна и эксперты расходятся во мнении относительно пользы проводимого исследования. Это: оценка функционирования системы в раннем послеоперационном периоде после имплантации ЭКС в качестве альтернативы телеметрическому мониторингу; оценка интенсивности суправентрикулярных аритмий у пациентов с кардиовертерами-дефибрилляторами.
К третьему классу относятся состояния, в отношении которых существует общее соглашение, что СМЭКГ не даёт полезной информации и это исследование не рекомендуется. Это: оценка неисправности ЭКС, когда тестирование устройства, обычная ЭКГ или другие данные достаточны для определения причины неисправности; рутинное динамическое наблюдение за бессимптомными пациентами.
Показания к ЭКГ-мониторированию в 2007 году были пересмотрены, одобрены рядом медицинских сообществ и сузились до двух: оценка работы устройства при наличии клинических подозрений на неисправность ЭКС при условии невозможности подтверждения данных подозрений обычной ЭКГ или программатором; оценка эффективности профилактической антиаритмической терапии при наличии рецидивирующих сердечных аритмий, а также оценка развития неблагоприятных реакций на медикаментозную терапию.
Существуют одно- и двухкамерные стимуляторы, но уже появляются и трёхкамерные системы с возможностью стимуляции не только правых, но и левых камер сердца (бивентрикулярная, многофокусная стимуляция). Режимы стимуляции также различны. Асинхронный режим теперь применяется крайне редко, является нефизиологическим и опасным - угроза развития желудочковых тахиаритмий при конкуренции собственного и артефициального ритмов. Физиологические режимы применяются как в одно-, так и в двухкамерных системах.
Встаёт вопрос: на что нужно обращать внимание врачу при расшифровке СМЭКГ у пациента с антиаритмическим устройством? Это: определение типа стимуляции; характеристика собственного ритма сердца и его нарушений (экстрасистолия, пароксизмальная тахикардия); оценка частотных характеристик, отвечающих за нижнюю границу стимуляционного ритма; оценка состояния АV-проведения при предсердной стимуляции или продолжительности АV/PV задержек при двухкамерной стимуляции; по возможности, нужна оценка работы алгоритмов устройства и, конечно же - выявление проблем в работе кардиостимулятора.
Большинство стимуляторов работает «по требованию» и для предсердного, и для желудочкового каналов стимуляции: они отслеживают события ритма (либо з.Р - предсердный стимулятор, либо з.R - желудочковый стимулятор) и в случае их отсутствия в течение интервала стимуляции наносят стимулирующий импульс, т. е. синхронизированы с зубцами Р и/или R. Следовательно, при появлении собственных сокращений, в том числе и эктопических (экстрасистолы) мы можем наблюдать и собственные, и сливные, и псевдосливные комплексы. Это норма.
Необходимо остановиться на оценке состояния сегмента ST и зубца Т. Это возможно осуществить только при изолированной предсердной стимуляции (режим AAI ). При правожелудочковой стимуляции даже в спонтанных комплексах эту оценку проводить нельзя в связи с так называемым феноменом «долгосрочной памяти сердца» или по описавшему его в 1969 году автору - синдромом Шатерье. Это ЭКГ-картина изменения конечной части желудочкового комплекса в виде отрицательных з.Т и депрессии сегмента. Связаны они с длительным энергетическим воздействием желудочковой стимуляции на миокард, меняющем молекулярный механизм работы ионных каналов. Этот феномен может наблюдаться чаще в нескольких, реже - во всех отведениях поверхностной ЭКГ, появляясь и исчезая в разные сроки после имплантации. Часто картина феномена Шатерье приводит к гипердиагностике инфаркта миокарда. Подчеркну, что ни ЭКГ, ни СМЭКГ не могут быть использованы для диагностики ишемии миокарда у пациентов с наличием даже «молчащего» в момент исследования желудочкового стимуляционного канала как на фоне однокамерной желудочковой стимуляции, так и в составе двухкамерного режима.
Нарушения в системе стимуляции по данным суточного мониторирования ЭКГ делятся на три группы: нарушения синхронизации стимула; нарушения стимулирующей функции устройства; нарушения ритма, обусловленные кардиостимуляцией.
Наиболее часто в клинической практике встречаются нарушения восприятия физиологическим стимулятором собственных предсердных или желудочковых сокращений, то есть его чувствительности, которая устанавливается при программировании (гипосенсинг). В результате гипочувствительности стимулятор не воспринимает собственное сокращение и наносит немотивированный стимул тогда, когда должен только следить за собственной активностью: картина приобретает вид асинхронной конкурирующей стимуляции, которая чревата угрозой развития фатальных аритмий.
Избыточная чувствительность (гиперсенсинг) встречается реже, чем гипосенсинг. Чаще наблюдается в однокамерных системах. Внутренняя гипердетекция при предсердной стимуляции может наблюдаться как в отношении зубцов основного ритма (R и Т, реже U), так и ретроградных зубцов Р, волн трепетания и фибрилляции предсердий, а при желудочковой - к зубцам Т и, реже - к з.Р основного ритма или эктопической желудочковой деполяризации.
Более редким проявлением нарушения чувствительности ЭКС к собственным сокращениям сердца является регистрация у одного пациента сочетания проявлений гипо- и гиперсенсинга. Чаще всего причиной данных комбинаций является истощение питания устройства, перелом или дислокация электрода, реже - нарушения в электронной схеме ЭКС. Такие ЭКГ вызывают наибольшие трудности при интерпретации.
Самым частым проявлением гиперсенсинга к внесердечным сигналам является миопотенциальное ингибирование, которое возникает при восприятии стимулятором внесердечных мышечных потенциалов (например, сокращения мышц плечевого пояса, грудных, диафрагмальных мышц). Миопотенциальное ингибирование провоцируется каким-либо действием пациента и проявляется на ЭКГ в виде пауз различной длительности, причём не кратных интервалу стимуляции. Когда при этом регистрируются шумовые помехи различной выраженности, множественные хаотичные неэффективные стимулы, «лохматость» изолинии, диагностика облегчается. Однако иногда помехи отсекаются фильтрами и на ЭКГ мы видим паузу с ровной изолинией. Тогда судить о причине этой паузы трудно. Ингибирование желудочкового ритма для пациента может пройти незамеченным, когда пауза гемодинамически незначимая или пациент имеет собственный желудочковый ритм под кардиостимулятором. У стимулятор-зависимых пациентов могут развиться синкопальные состояния. Поэтому при наличии пауз ритма больной должен быть срочно направлен к специалисту для диагностики системы стимуляции.
Нарушение стимулирующей функции кардиостимулятора проявляется наличием неэффективных стимулов. Причиной неэффективных стимулов может быть как работа специальных алгоритмов современной стимуляции, так и нарушения в работе системы. Врач не может по ЭКГ выявить причину неэффективной стимуляции, он лишь может констатировать факт постоянного или преходящего наличия неэффективных стимулов, а задача лечащего врача - направить пациента к специалисту для тестирования устройства.
Пейсмекерные аритмии делятся на суправентрикулярные и желудочковые. В основе пейсмекерных аритмий часто лежит вентрикулоатриальное проведение (ВАП). Это обратное распространение возбуждения из желудочка на предсердия с их деполяризацией. ВАП может наблюдаться после эктопического или стимулированного желудочкового комплекса как у больных с нормальной АВ-проводимостью, так и при её нарушении. Выявление на СМЭКГ эпизодов ВАП надо обязательно отражать в заключении, так как именно потеря АВ-синхронизации при желудочковой стимуляции является причиной симптомокомплекса, получившего название синдром кардиостимулятора.
При двухкамерной стимуляции сохранное ВАП может создать основу для круговой пейсмекерной тахикардии по механизму ри-ентри: ретроградный з.Р устройство воспринимает как собственное синусовое сокращение и даёт начало стимуляции желудочков, откуда импульс вновь ретроградно проводится на предсердия, замыкая бесконечный круг, одним из звеньев которого является кардиостимулятор.
В современных устройствах используется несколько алгоритмов для предотвращения и купирования пейсмекерных тахикарий. При наличии алгоритмов купирования пейсмекерной тахикардии эти эпизоды не превышают десяти секунд, поэтому при регистрации на СМЭКГ эпизодов пейсмекерной тахикардии необходимо указать их длительность и переносимость пациентом. Если они часто рецидивируют, продолжительны по времени, больной плохо их переносит, то необходимо осуществить контроль устройства у специалиста.
Пейсмекерная экстрасистолия - это экстрасистолия, причиной которой является стимулятор. Она может быть единичная или с эпизодами аллоритмии. «Проаритмогенным» действием чаще обладает желудочковая стимуляция, которая может приводить не только к развитию желудочковых экстрасистолий, но и других нарушений ритма, в том числе и фибрилляции предсердий, поэтому в настоящее время стремятся при программировании устройств к уменьшению желудочковой стимуляции, отдавая предпочтение преобладанию собственного ритма. Порой приходится дифференцировать пейсмекерную экстрасистолию от собственной спонтанной экстрасистолии. Но это не всегда возможно. Ещё сложнее диагностика в случаях, когда у одного пациента регистрируется и спонтанная и пейсмекерная экстрасистолия.
В некоторых случаях может возникнуть явление альтернации ритма или «искусственная парасистолия». Возникает она при приближении частоты собственного ритма к частоте стимуляции или в случае, когда желудочковая стимуляция не подавляет собственные очаги импульсации ниже синусового узла. При этом наблюдается существование двух очагов импульсации: более частый - стимуляционный и более редкий - собственный. Вследствие этого на ЭКГ регистрируется картина, напоминающая парасистолию (собственные желудочковые сокращения будут выглядеть как экстрасистолы, не являясь ими). Пейсмекерная экстрасистолия, как и собственная, не требует лечения, если нет жалоб. Если же жалобы имеются, то подбирается антиаритмическая терапия. Поэтому врач при анализе СМЭКГ должен просто указать наличие экстрасистол, их моно/полиморфность, наличие парных и групповых, а в случае подозрения высказаться предположительно, а не абсолютно за пейсмекерную экстрасистолию.
Далеко не всегда то, что кажется нарушением, им и является. Например, безответные стимулы могут не являться истинно неэффективными, а урежение стимуляционного ритма вплоть до значительных пауз может быть проявлением нормальной работы стимуляционных алгоритмов. Тем более не всегда, а скорее всего - редко «плохое» самочувствие пациента найдёт своё подтверждение на записи СМЭКГ.
— В. Карловская,врач отделения функциональной
и ультразвуковой диагностики
областного кардиодиспансера


