Depresja. Tłuszcze obojętne, oleje: ogólna charakterystyka, utlenianie, uwodornienie
Tłuszcze obojętne obejmują grupę lipidów składającą się z alkoholu trójwodorotlenowego – glicerolu i trzech reszt Kwasy tłuszczowe stąd nazywane są triglicerydami.
Skład tłuszczów obojętnych może zawierać te same kwasy tłuszczowe, np. palmitynowy. W tym przypadku powstaje ester - trigliceryd, tripalmityna. To są proste tłuszcze. Jeśli tłuszcze zawierają pozostałości różnych kwasów tłuszczowych, powstają tłuszcze mieszane.
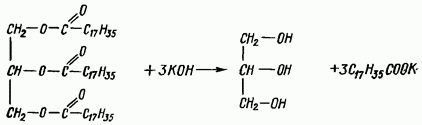
To równanie reakcji pokazuje odwracalne procesy syntezy (górna strzałka) i hydrolizy (dolna) tłuszczu.
Tłuszcze naturalne wyróżniają się dużą różnorodnością zawartych w ich składzie kwasów tłuszczowych, różnym ich ułożeniem w cząsteczce oraz stopniem nienasycenia. Potencjalnie mogą istnieć miliony izomerów triglicerydów.
Kwasy tłuszczowe to kwasy organiczne o długim łańcuchu węglowodorowym (rodnik R) zawierające od 4 do 24 lub więcej atomów węgla i jedną grupę karboksylową. Ogólna formuła kwasy tłuszczowe mają postać
СnН2n + 1СООН lub R-COOH.
Wiele kwasów tłuszczowych charakteryzuje się parzystą liczbą atomów węgla, co najwyraźniej wynika z ich syntezy poprzez dodanie dwuwęglowych jednostek do rosnącego łańcucha węglowodorowego.
W skład tłuszczów w organizmie człowieka wchodzą najczęściej kwasy tłuszczowe o 16 lub 18 atomach węgla, które nazywane są wyższymi kwasami tłuszczowymi. Wyższe kwasy tłuszczowe dzielą się na nasycone nasycone i nienasycone (nienasycone)
W nasyconych kwasach tłuszczowych wszystkie wolne wiązania atomów węgla są wypełnione wodorem. Te kwasy tłuszczowe nie mają podwójnych lub potrójnych wiązań w łańcuchu węglowym. Nienasycone kwasy tłuszczowe mają podwójne wiązania w łańcuchu węglowym (-C=C-), z których pierwsze występuje między dziewiątym a dziesiątym atomem węgla z grupy karboksylowej. Kwasy tłuszczowe z wiązaniami potrójnymi są rzadkie. Kwasy tłuszczowe zawierające dwa lub więcej wiązań podwójnych nazywane są wielonienasyconymi.
Wraz ze wzrostem liczby atomów węgla w cząsteczkach kwasów tłuszczowych wzrasta ich temperatura topnienia. Kwasy tłuszczowe mogą być stałe (np. stearynowy) lub ciekły (np. linolowy, arachidonowy); są nierozpuszczalne w wodzie i bardzo słabo rozpuszczalne w alkoholu.
Tłuszcze stałe to tłuszcze pochodzenia zwierzęcego, z wyjątkiem olej rybny. płynne tłuszcze Są to oleje roślinne, z wyjątkiem olejów kokosowego i palmowego, które krzepną po schłodzeniu. U zwierząt i roślin jest dwa razy więcej nienasyconych kwasów tłuszczowych niż nasyconych kwasów tłuszczowych.
Nienasycone kwasy tłuszczowe są bardziej reaktywne niż nasycone. Z łatwością przyłączają dwa atomy wodoru w miejscu podwójnych wiązań, zamieniając się w nasycone:
Ten proces nazywa się uwodornianiem. Substancje poddane uwodornieniu zmieniają swoje właściwości. Na przykład oleje roślinne zamieniają się w tłuszcz stały. Reakcja uwodornienia jest szeroko stosowana do otrzymywania stałego tłuszczu jadalnego - margaryny z ciekłych olejów roślinnych.
Wielonienasycone kwasy tłuszczowe mają szczególne znaczenie dla człowieka. Nie są syntetyzowane w organizmie. Wraz z ich niedoborem lub brakiem w pożywieniu zaburzony jest metabolizm tłuszczów, w szczególności cholesterolu, obserwuje się zmiany patologiczne w wątrobie, skórze i czynności płytek krwi. Dlatego nienasycone kwasy tłuszczowe, takie jak linolenowy i linolowy, są niezbędnymi czynnikami odżywczymi.
Ponadto przyczyniają się do uwalniania z wątroby tłuszczów, które są w niej syntetyzowane i zapobiegają jej otyłości. Ten efekt nienasyconych kwasów tłuszczowych nazywany jest efektem lipotropowym. Nienasycone kwasy tłuszczowe służą jako prekursory do syntezy biologicznej substancje aktywne- prostaglandyny. Su-dokładna ludzka potrzeba kwasy wielonienasycone normalnie wynosi około 15g.
Tłuszcze neutralne gromadzą się w komórkach tłuszczowych (adipocytach), pod skórą, w gruczołach sutkowych, otoczkach tłuszczowych wokół narządy wewnętrzne Jama brzuszna; niewielka liczba z nich jest w mięśnie szkieletowe. Tworzenie i gromadzenie obojętnych tłuszczów w tkankach tłuszczowych nazywa się odkładaniem. Trójglicerydy stanowią podstawę tłuszczów rezerwowych, które stanowią rezerwę energetyczną organizmu i są wykorzystywane podczas głodu, niedostatecznego spożycia tłuszczu, długotrwałego aktywność fizyczna.
Tłuszcze obojętne są również częścią błon komórkowych, złożonych białek protoplazmy i nazywane są protoplazmami. Tłuszcze protoplazmatyczne nie są wykorzystywane jako źródło energii, nawet gdy organizm jest wyczerpany, ponieważ pełnią funkcję strukturalną. Ich liczba i skład chemiczny są stałe i nie zależą od składu pożywienia, natomiast skład tłuszczów rezerwowych stale się zmienia. U ludzi tłuszcze protoplazmatyczne stanowią około 25% całkowitej masy tłuszczu w ciele (2-3 kg).
W różnych komórkach organizmu, zwłaszcza w tkance tłuszczowej, stale zachodzą enzymatyczne reakcje biosyntezy i rozkładu tłuszczów obojętnych:
Podczas hydrolizy tłuszczów w organizmie powstaje glicerol i wolne kwasy tłuszczowe. Proces ten jest katalizowany przez enzymy lipazy. Proces hydrolizy tłuszczów w tkankach ciała nazywany jest lipolizą. Tempo lipolizy znacznie wzrasta podczas ćwiczeń wytrzymałościowych, a aktywność lipazy wzrasta podczas ćwiczeń.
Jeśli reakcja rozkładu tłuszczu odbywa się w obecności zasad (NaOH, KOH), to powstają sole sodowe lub potasowe kwasów tłuszczowych, zwane mydłami, a sama reakcja jest zmydlaniem. Ta reakcja chemiczna leży u podstaw produkcji mydła z różnych tłuszczów i ich mieszanin.
Fosfolipidy
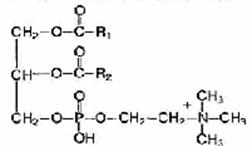
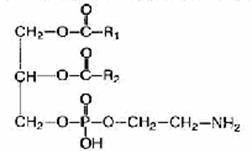
Fosfolipidy to substancje tłuszczopodobne składające się z alkoholu (zwykle glicerolu), dwóch reszt kwasów tłuszczowych, reszty kwasu fosforowego i substancji zawierającej azot (aminoalkohol - cholina lub kolamina).
Jeśli cholina jest zawarta w cząsteczkach fosfolipidów, nazywa się je lecytynami, a kolamina kefalinami.
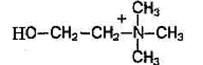
 Cholina Kolamina
Cholina Kolamina
Alfa Lecytyna Alfa Kefalina
Struktura izomerów beta różni się tym, że reszty kwasu fosforowego i aminoalkoholu znajdują się przy drugim (środkowym) atomie węgla glicerolu.
Fosfatydy, zwłaszcza lecytyna in w dużych ilościach znaleźć w żółtku jaj. W ludzkim ciele są szeroko rozpowszechnione w tkance nerwowej. Fosfolipidy pełnią ważną rolę biologiczną, będąc składnikiem strukturalnym wszystkich błon komórkowych, dostarczając choliny niezbędnej do tworzenia neuroprzekaźnika acetylocholiny. Takie właściwości błon, jak przepuszczalność, funkcja receptorów i aktywność katalityczna enzymów związanych z błoną zależą od fosfolipidów.
Fosfolipidy dominują w błonach komórka zwierzęca, są one również zawarte w wielu jego cząstkach subkomórkowych.
Biologiczna rola fosfolipidów w organizmie jest znacząca i zróżnicowana. Fofolipidy jako niezbędny składnik błon biologicznych biorą udział w ich funkcjach barierowych, transportowych, receptorowych, w podziale przestrzeni wewnętrznej komórki na organelle komórkowe - „zbiorniki”, przedziały. Te funkcje błon są obecnie uważane za jeden z najważniejszych mechanizmów regulujących aktywność życiową komórek. Obecność fosfolipidów w błonach jest również niezbędna do funkcjonowania związanych z błoną układów enzymatycznych.
STEROIDY

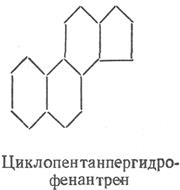
Sterydy to niezmydlające się lipidy. Z natury chemicznej steroidy są pochodnymi cyklopentanoperhydrofenantrenu. Dzielą się na sterole i sterydy. Sterole to cykliczne alkohole o dużej masie cząsteczkowej, które mają w swojej cząsteczce rdzeń.
 |
W skład różnych tkanek wchodzą również sterydy – estry utworzone przez sterole i kwasy tłuszczowe. Sterole i ich pochodne pełnią w organizmie różne funkcje. duża znaczenie biologiczne w ciele zwierzęcia ma cholesterol. Zakłócenie jego metabolizmu może prowadzić do: zmiany patologiczne naczynia - miażdżyca. Cholesterol służy jako biologiczny prekursor kwasów żółciowych, hormonów steroidowych. Kwasy żółciowe mają ogromne znaczenie w procesie rozkładu lipidów w jelicie. Hormony steroidowe regulują liczne procesy metaboliczne.
BIAŁKA
Najważniejszymi związkami każdego organizmu są białka. Są one koniecznie znalezione we wszystkich komórkach ciała, w większości z nich udział białka stanowi ponad połowę suchej pozostałości. Wszystkie główne przejawy życia są związane z białkami. „Życie”, napisał F. Engels, „jest sposobem na istnienie ciał białkowych… Wszędzie, gdzie spotykamy życie, odkrywamy, że jest ono związane z jakimś ciałem białkowym i wszędzie tam, gdzie spotykamy ciało białkowe, która nie jest w trakcie rozkładu, bez wyjątku spotykamy przejawy życia.
Białka - zawierające azot o wysokiej masie cząsteczkowej związki organiczne składa się z reszt aminokwasowych. W składzie niektórych białek obok aminokwasów znajdują się również inne związki.
Żywe organizmy charakteryzują się dużą różnorodnością białek, które stanowią podstawę budowy organizmu i pełnią wiele jego funkcji. Uważa się, że w przyrodzie występuje około 1010-1012 różnych białek, co tłumaczy ogromną różnorodność żywych organizmów. W organizmach jednokomórkowych znajduje się około 3000 różnych białek, a w ludzkim ciele około 5 000 000.
Pomimo złożoności struktury i różnorodności, wszystkie białka zbudowane są ze stosunkowo prostych elementów strukturalnych – aminokwasów. Białka to polimerowe cząsteczki składające się z 20 różnych aminokwasów. Zmiana liczby reszt aminokwasowych i kolejności ich umiejscowienia w cząsteczce białka umożliwia powstanie ogromnej liczby białek różniących się właściwościami fizykochemicznymi, rolą strukturalną lub funkcjonalną w organizmie.
Dla każdego organizmu białka odgrywają kluczową rolę we wszystkich procesach życiowych. Wiążą się one z takimi właściwościami żywego organizmu, jak drażliwość, kurczliwość, trawienie, zdolność do wzrostu, rozmnażania i poruszania się. Dlatego białka są głównymi nośnikami życia. W przyrodzie nieożywionej związki takie jak białka nie występują.
Skład chemiczny i biologiczna rola białek
Białka to wysokocząsteczkowe substancje zawierające azot, podczas hydrolizy których powstają aminokwasy. Czasami białka nazywa się białkami (od greckiego proteus - pierwszy, główny), tym samym je definiując zasadnicza rola w życiu wszystkich organizmów. Białko w organizmie człowieka stanowi średnio 45% suchej masy ciała (12-14 kg). Jego zawartość w poszczególnych tkankach jest różna. Najwięcej białka znajduje się w mięśniach, kościach, skórze, przewodzie pokarmowym i innych gęstych tkankach.
Dobowe zapotrzebowanie na białko osoby dorosłej, która nie uprawia sportu wynosi średnio 1,3 g na 1 kg masy ciała, czyli ok. 80 g. Przy dużym wydatku energetycznym zapotrzebowanie na nie wzrasta o ok. 10 g na każde 2100 kJ wzrostu wydatki na energię .
Białka dostają się do organizmu głównie z żywnością pochodzenia zwierzęcego. Rośliny zawierają znacznie mniej białka: w warzywach i owocach – tylko 0,3-2,0% masy świeżej tkanki; największa ilość białka - w roślinach strączkowych - 20-30%, zbożach - 10-13 i grzybach - 3-6%.
Skład elementarny białek. Najważniejszymi pierwiastkami chemicznymi wszystkich białek są węgiel (50-55%), tlen (21-23%), wodór (6,5-7,3%), azot (15-18%), siarka (0,3-2,5%). Białka zawierają również fosfor, żelazo, jod, miedź, mangan i inne pierwiastki chemiczne.
BIOCHEMIA LIPIDÓW
Ogólna charakterystyka lipidów
Lipidy (z greckiego lipos – tłuszcz) nazywane są tłuszczami i substancjami tłuszczopodobnymi. Znajdują się we wszystkich żywych komórkach i pełnią szereg funkcji życiowych. ważne funkcje: strukturalne, metaboliczne, energetyczne, ochronne itp. Nie rozpuszczają się lub słabo rozpuszczają w wodzie, dobrze rozpuszczają się w rozpuszczalnikach organicznych. Większość z nich to pochodne alkoholi, wyższych kwasów tłuszczowych lub aldehydów.
Właściwości chemiczne i biologiczne znaczenie lipidów determinowane są obecnością w ich cząsteczkach niepolarnych łańcuchów węglowych i grup polarnych: -COOH, -OH, -NH 2 itp. Dzięki temu mogą być powierzchniowo czynne, uczestniczyć w przepuszczalność błon komórkowych i łatwo rozpuszczalne w rozpuszczalnikach organicznych, być rozpuszczalnikami witamin i innych związków.
Istnieją dwie grupy lipidów: proste i złożone. Cząsteczki prosty lipid powstają z pozostałości alkoholi (glicerol, glikole, wyższe lub cykliczne) oraz wyższe kwasy tłuszczowe. Są to tłuszcze obojętne, lipidy diolowe, sterydy i woski. Cząsteczki złożony lipid składają się z pozostałości alkoholi, wyższych kwasów tłuszczowych i innych substancji (zasady azotowe, H 3 PO 4 , H 2 SO 4 , węglowodany itp.). Złożone lipidy obejmują fosfatydy, glikolipidy, sulfatydy. Często do lipidów należą mono- i diglicerydy, sterole, karoteny i inne bliskie im substancje.
tłuszcze neutralne. Są mieszaniną trójglicerydów - estrów tworzonych przez trójwodorotlenowy alkohol glicerol i wyższe kwasy tłuszczowe.
Wyższe kwasy tłuszczowe reprezentowane są przez nasycone, nienasycone i cykliczne kwasy karboksylowe, aw niektórych przypadkach - hydroksykwasy.
Nasycone kwasy karboksylowe mają zwykle parzystą liczbę atomów węgla, na przykład:

Nieparzyste kwasy węglowe często mają rozgałęziony łańcuch węglowy, taki jak izowalerianowy:

Nienasycone kwasy karboksylowe mogą mieć od jednego do czterech podwójnych wiązań, na przykład:
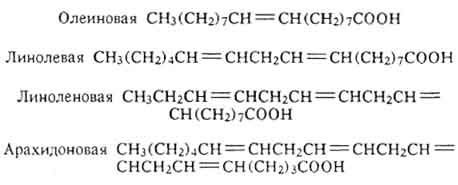
W składzie tłuszczów znajdują się pozostałości kwasów cyklicznych np. chaulmogric C 17 H 29 COOH oraz hydroksykwasy np.:

Trójglicerydy są proste i złożone. Skład prostej cząsteczki triglicerydu obejmuje reszty jednego kwasu tłuszczowego, złożonego triglicerydu - dwa lub trzy kwasy tłuszczowe:

Tłuszcze są szeroko rozpowszechnione w przyrodzie. W składzie tłuszczów zwierzęcych przeważają pozostałości
nasycone kwasy tłuszczowe, co decyduje o ich stałej konsystencji. Masło krowie jest ważne smalec, tłuszcze baranie i wołowe. Tłuszcze pochodzenie roślinne w swoim składzie zawierają głównie pozostałości nienasyconych kwasów tłuszczowych i są cieczami (z wyjątkiem oleju palmitynowego). Najczęściej stosowany słonecznik, oliwka, siemię lniane, olejek migdałowy itd.
Różne pokarmy i karmy zawierają różne ilości tłuszczu. W roślinach są zwykle skoncentrowane w nasionach, mniej w owocach. Tak więc nasiona rącznika zawierają 58-78% tłuszczu, rzepak - 36-40, len - 28,9-49, słonecznik - 29-57, ziarna kukurydzy - 5, owies - 3, pszenica 1-1,8%.
U zwierząt tłuszcze są skoncentrowane głównie w Tkanka podskórna(do 50%), sieć, torebki tkanki łącznej nerek i narządów płciowych, w wątrobie i tkance mięśniowej. Płyny biologiczne są ubogie w tłuszcze. Spośród nich stosunkowo wysoki procent tłuszcz ma mleko (krowa - 3,5%, jeleń - 17,1%). Tłuszcze są najważniejszym źródłem energii chemicznej. Tak więc podczas utleniania tkanek 1 g tłuszczu powstaje 9,3 kcal (1 g węglowodanów daje 4,3 kcal, białka - 4,1 kcal). Tłuszcze są źródłem endogennej wody: gdy 100 g tłuszczów ulega utlenieniu w tkankach, powstaje 107,1 g wody, co jest bardzo ważne dla zwierząt żyjących na południowych szerokościach geograficznych (np. dla wielbłądów) lub hibernujących (np. , dla niedźwiedzi brunatnych). Tłuszcze - rozpuszczalniki materia organiczna zwłaszcza witaminy rozpuszczalne w tłuszczach. Biorą udział w termoregulacji, ponieważ mają niską pojemność cieplną, chronią organizm przed uszkodzenie mechaniczne(zawarte w kapsułkach serca, nerek, wątroby, oczu), określają elastyczność skóry.
Istnieją tłuszcze rezerwowe (rezerwowe) i protoplazmatyczne (strukturalne). Pierwsze z nich są konsumowane przez organizm na różne potrzeby, o których była mowa powyżej. Te ostatnie są składnikami błon komórkowych, wchodzą w skład kompleksów lipoproteinowych.
Tłuszcze to pokarm dla ludzi i zwierząt. Oleje roślinne można stosować do
przygotowanie oleju schnącego i lakierów. Wiele z nich, oprócz celów spożywczych i tuczu zwierząt (makuchy), można uwodorniać i pozyskiwać różne odmiany margaryny. Tłuszcze z wątroby dorsza są wykorzystywane jako źródło witamin A i D. Tłuszcze techniczne są stosowane w różne obszary Gospodarka narodowa(w przemyśle lekkim, chemicznym i innych).
Jakość i czystość tłuszczów charakteryzują stałe fizyczne i chemiczne (tab. 3). Stałe fizyczne: gęstość, temperatura topnienia i temperatura płynięcia, współczynnik załamania światła (dla tłuszczów płynnych); stałe chemiczne: liczba zmydlania, Reichard - Meisl, jod, kwas i kilka innych wskaźników.
Numer zmydlania zależy od liczby miligramów KOH użytego do neutralizacji kwasów tłuszczowych, które powstają podczas zmydlania 1 g tłuszczu.
Numer Reicharda-Meisla charakteryzuje się ilością 0,1 n. Roztwór NaOH służący do neutralizacji lotnych kwasów tłuszczowych (masłowego, kapronowego i kaprylowego) powstałych podczas hydrolizy 5 g tłuszczu i destylowanych parą wodną.
liczba jodowa charakteryzuje obecność nienasyconych kwasów tłuszczowych w składzie tłuszczu i jest determinowana liczbą gramów jodu, jaką można dodać do 100 g tłuszczu.
Liczba kwasowa wskazuje na obecność wolnych kwasów tłuszczowych w składzie tłuszczu, które
3. Stałe fizyczne i chemiczne niektórych tłuszczów
| Stałe | Rodzaj tłuszczu | ||
| wołowina | baranina | mięso wieprzowe | |
| Gęstość w 15°C, g/cm3 | 0,923-0,933 | 0,932-0,961 | 0,931-0,938 |
| Temperatura topnienia, °C | 42-52 | 44-55 | 36-46 |
| Temperatura płynięcia, °С | 27-38 | 32-45 | 26-32 |
| Współczynnik załamania (w 40°C) | 1,4510-1,4583 | 1,4566-1,4583 | 1,4536 |
| Numer zmydlania | 190-200 | 192-198 | 193-200 |
| Numer Reicharda-Meisla | I | 0,3-0,9 | |
| liczba jodowa | 32-47 | 31-40 | 46-56 |
| Liczba kwasowa | 0,1-0,6 | 0,1-0,2 | 0,3-0,9 |
utworzony przez rozkład jego cząsteczek. Decyduje o tym ilość miligramów KOH użytego do neutralizacji wolnych kwasów tłuszczowych, które zawarte są w 1 g tłuszczu.
Rozważane stałe zależą od siedliska, warunków żywieniowych, wieku, płci, rasy zwierzęcia i innych czynników. Tak więc S. L. Iwanow odkrył, że zwierzęta żyjące na północnych szerokościach geograficznych mają tłuszcze, które charakteryzują się większą ilością niskie temperatury topnienia niż u zwierząt tego samego gatunku hodowanych na południu. W składzie tłuszczów te pierwsze zdominowane są przez pozostałości nienasyconych kwasów tłuszczowych, natomiast te drugie są nasycone.
lipidy diolowe. Lipidy te zostały odkryte w tkankach roślin i zwierząt przez radzieckiego naukowca L.D. Ogólna formuła
gdzie n = 0, 1, 2, 3.
Pełnią te same funkcje w organizmie co tłuszcze. Mało studiował.
Sterydy. Sterydy nazywane są estrami steroli i wyższych kwasów tłuszczowych (najczęściej palmitynowych). Sterole lub sterole to cykliczne alkohole o dużej masie cząsteczkowej, pochodne cyklopentanoperhydrofenantrenu. Ten ostatni można uznać za produkt kondensacji uwodornionego fenantrenu i cyklopentanu. Poszczególne pierścienie w cyklopentanoperhydrofenantrenie są oznaczone literami (A, B, C, D), a atomy węgla pierścieni są oznaczone liczbami.

Sterole i sterydy tworzą niezmydlającą się frakcję lipidów i są częścią błon komórkowych. W
w tkankach wątroby zawartość sterydów wynosi około 50% całkowitej masy wszystkich steroli. Istnieją zoo-, fito- i mykosterole. Pochodnymi steroli są liczne hormony steroidowe (kora płciowa i kory nadnerczy), kwasy żółciowe, witaminy z grupy D, alkaloidy steroidowe, niektóre antybiotyki triterpenowe, trucizny gruczołów skórnych ropuch oraz niektóre czynniki rakotwórcze. Sterole to substancje krystaliczne, optycznie czynne, prawie nierozpuszczalne w wodzie, rozpuszczalne w rozpuszczalnikach organicznych, bezbarwne, zdolne do sublimacji, wchodzące w reakcje chemiczne charakterystyczne dla alkoholi.
Największym zainteresowaniem cieszą się cholesterol i jego pochodne – chrlesterydy, które są estrami cholesterolu i wyższych kwasów tłuszczowych. Cholesterol odkryto w XVIII wieku. Conradi o badaniach kamienie żółciowe. Występuje obficie w istocie białej mózgu. Chemicznie cholesterol jest drugorzędowym alkoholem cyklicznym.
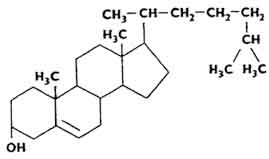
Szacuje się, że organizm człowieka ważący 70 kg zawiera około 140 g cholesterolu, z czego 10% koncentruje się w nadnerczach, 2% w układzie nerwowym, a 0,25% w kościach. Dużo cholesterolu w wątrobie (od 0,333 do 0,91% całkowitej masy). Cholesterol jest w stanie zatrzymać pewną ilość wody. Cholesterol tworzy złożone związki z białkami.
Sterole są wydalane z organizmu głównie w postaci cholesterolu (patrz wyżej) i koprosterolu.
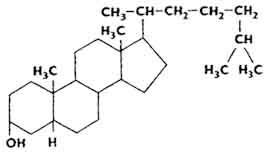
W skórze zwierząt oraz w niezmydlającej się frakcji lipidów znajduje się 7-dehydrocholesterol, prowitamina witaminy D 3 . Drożdże zawierają ergosterol, prowitaminę witaminy D 2 (patrz rozdział „Witaminy”).
Woski. Woski to duża grupa lipidów, których cząsteczki powstają z reszt wyższych kwasów tłuszczowych i wyższych alkoholi jednowodorotlenowych. Stosunek węgla w kwasowej i alkoholowej części cząsteczki wynosi 1:1 lub 2:1. Woski zawierają zanieczyszczenia wolnych kwasów tłuszczowych i alkoholi, węglowodory (C 27 – C 33) oraz substancje zapachowe. Ze względu na pochodzenie istnieją zwierzęta (pszczoła, lanolina, spermacet), roślinne (karnauba, kandelilla), produkt wydalania niektórych owadów (chiński), skamieniałości (cerezyna i montan) oraz syntetyczne.
Wosk pszczeli . Wytwarzany przez gruczoły woskowe pszczół. Składa się z mieszaniny estrów (do 75%), wolnych wyższych kwasów tłuszczowych i węglowodorów nasyconych. Zawiera witaminę A i kilka innych substancji. Bazą wosku jest ester alkoholu mirycylowego i kwasu palmitynowego:
Wosk pszczeli nie rozpuszcza się w wodzie, znika w chloroformie i eterze dietylowym, benzynie i terpentynie. Jest podstawą plastrów miodu. Służy do sporządzania maści i plastrów.
Lanolina. Otrzymywany po praniu wełny owczej. Jest to mieszanina estrów utworzonych przez wyższe alkohole (cetyl, karnauba, cholesterol itp.) oraz wyższe kwasy tłuszczowe (lanopalmitynowy, mirystynowy itp.). Za pomocą właściwości fizyczne- jest to gęsta, lepka masa koloru brązowo-żółtego o lekkim zapachu, nie rozpuszcza się w wodzie, rozpuszcza się w chloroformie, eterze, jest higroskopijna, nie zmydla się wodnymi roztworami zasad, nie jełcze. Używany do gotowania maści lecznicze oraz w kosmetykach.
Spermacet. To składnik oleju spermaceti, który pozyskiwany jest z mózgu kaszalotów. Z jednego kaszalota można uzyskać 4-5 ton
spermacet. Jego głównym składnikiem (do 90%) jest ester kwasu palmitynowego i alkoholu cetylowego:
Część spermacetu (10%) - estry alkoholi cetylowego, stearynowego, oleinowego oraz kwasu laurynowego, mirystynowego.
Spermaceti - białe blaszkowate kryształy, łatwo rozpuszczalne w eterze dietylowym, acetonie, gorącym etanolu, nierozpuszczalne w wodzie. Służy do przygotowania maści leczniczych i kosmetyki. Stosowany w leczeniu owrzodzeń skóry.
woski roślinne. Rozpowszechniony w przyrodzie. Liście, łodygi, pnie i owoce roślin pokryte są cienką warstwą. Chroń tkanki roślinne przed urazami i drobnoustrojami. Uczestniczyć w regulacji metabolizmu wody. Są mieszaniną estrów utworzonych przez wyższe alkohole (cetyl, mirycyl) i kwasy tłuszczowe (cerotynowy, karnaubowy, montanowy, stearynowy, palmitynowy, oleinowy). Wosk Carnauba jest szeroko stosowany do wyrobu świec itp. Pozyskiwany jest z liści niektórych palm. Bazą wosku jest ester alkoholu mirycylowego i kwasu cerotynowego:
Fosfatydy. Cząsteczka fosfatydu składa się z reszt wyższych alkoholi i wyższych kwasów tłuszczowych, kwasu fosforowego i zasady azotowej. Razem z innymi lipidami i białkami stanowią podstawę chemiczną błon komórkowych, decydują o ich selektywnej przepuszczalności dla różnych substancji, uczestniczą w procesach oddychania komórkowego i przenoszenia elektronów.
Cząsteczka fosfatydu zwykle składa się z dwóch części: polarnej (hydrofilowej) i apolarnej
(hydrofobowy). Hydrofilowa „głowa” ma ujemny ładunek fosforanu i dodatni ładunek azotu, będąc stałym dipolem (jonem dwubiegunowym). Hydrofobowy „ogon” składa się z długich łańcuchów reszt wyższych kwasów tłuszczowych. To właśnie ta struktura cząsteczki determinuje właściwości powierzchniowo czynne lipidu, umożliwia tworzenie struktur błony w monowarstwie na granicy faz, interakcję z różnymi (polarnymi i apolarnymi) związkami oraz czynny udział w asymilacji i dyssymilacji reakcje.
Najwięcej fosfatydów znajduje się w tkance nerwowej (do 26-30% suchej masy), wątrobie (16%), nerkach (11%) i sercu (10%). Są syntetyzowane w kompleksie Golgiego.
Istnieją fosfatydy glicero-, inozytolu i sfingozyny.
Glicerofosfatydy
Lecytyny lub folinofosfatydy. W tworzeniu cząsteczek α - oraz β -lecytyny obejmują glicerol, nasycone i nienasycone wyższe kwasy tłuszczowe, H 3 PO 4 oraz cholinę. W α -lecytyna, reszta cholinowa i H3PO4 znajdują się w pobliżu atomu C1 cząsteczki alkoholu.
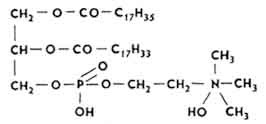
Dużo lecytyny znajduje się w tkankach rdzenia kręgowego i mózgu (35,2-12,4%), żółtko kurze jajo(6,5-12%), płuca, mięsień sercowy, nerki (5,9-5,2%), itd. Jest wykorzystywany przez organizm do biosyntezy acetidcholiny. Stosuje się go doustnie (w postaci drażetek) w leczeniu chorób system nerwowy, anemia, ogólna utrata sił.
Wiele pokarmów roślinnych jest również bogatych w lecytynę: nasiona słonecznika (38,5%), len (36,2%), soja (35%) itd.
kefaliny, lub fosfatydy kolaminy. Cząsteczki kefalin zawierają etanoloaminę (kolaminę).
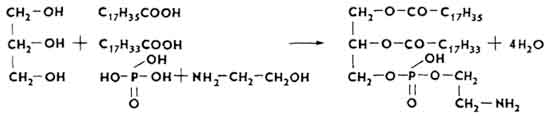
Frakcja cefalinowa stanowi bazę lipidową ludzkiej tkanki mózgowej (66%), duża wątroba bydło(51%), mięsień sercowy (30%), żółtko jaja (28,7%). Soja (65%), nasiona bawełny (71,2%), nasiona lnu i słonecznika (61,5%) są bogate w kefaliny. Cefaliny tworzą kompleksy lipoproteinowe z białkami. Wiele z nich znajduje się w mitochondriach.
Fosfatydy seryny. W cząsteczce fosfatydów seryny zasada azotowa jest aminokwasem serii.
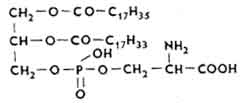
W tkance nerwowej, wątrobie, nerkach i innych narządach występuje wiele fosfatydów seryny. Są to lipidy protogazmatyczne. W mitochondriach jest ich wiele.
Pomiędzy lecytynami, kefalinami i fosfatydami serynowymi znajduje się połączenie genetyczne, ponieważ zasady azotowe mogą przechodzić między sobą:
Acetalfosfatydy(plazmalogeny). Struktura acetalfosfatydów obejmuje aldehydy wyższych kwasów tłuszczowych. Najczęściej acetalfosfatydy mają następującą strukturę:

Różnią się między sobą zasadami azotowymi, wyższymi kwasami tłuszczowymi i ich aldehydami, a także sposobami tworzenia acetali. Stanowią około 12% wszystkich fosfatydów tkankowych. Frakcja etanoloaminokefaliny w mózgu składa się z 2/3 acetalfosfatydów; plemniki o 55-60%. W poszczególne organy(wątroba, mięsień sercowy, nerki, mięśnie) zawartość acetalfosfatydów wzrasta wraz z wiekiem.
Kardiolipiny. Najpierw wyizolowany z ekstraktu z mięśnia sercowego. Ich cząsteczka oparta jest na trzech resztach glicerolowych połączonych wiązaniami fosfodiestrowymi typu 1,3 (R - reszty wyższych kwasów tłuszczowych).

Kardiolipiny zajmują prawie 10% wszystkich lipidów mitochondrialnych. Te lipidy biorą udział w fosforylacji oksydacyjnej i przenoszeniu elektronów, w wiązaniu dopełniacza podczas krzepnięcia krwi.
Inozytrofosfatydy
Ich cząsteczką jest ester utworzony przez glicerol, wyższe kwasy tłuszczowe, H 3 PO 4 i inozytol, alkohol sześciowodorotlenowy. Istnieją monofosfoinozytydy i difosfoinozytydy.
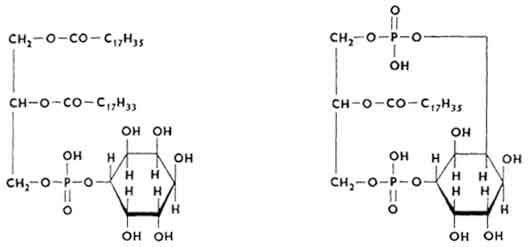
Wiele fosfatydów inozytolu znajduje się w tkance nerwowej (mózgu), zwłaszcza w osłonkach mielinowych. włókna nerwowe. Mogą tworzyć się fosfatydy inozytolu
złożone związki z białkami. Reszta inozytolu może reagować z galaktozą, kwasem tatronowym i wyższymi kwasami tłuszczowymi, kolaminą, łącząc w jedną całość produkty przemiany materii białek, węglowodanów i lipidów charakterystycznych dla tkanki nerwowej.
Fosfatydy sfingozyny
Cząsteczki fosfatydu sfingozyny powstają z reszt sfingozyny, wyższych kwasów tłuszczowych, kwasu fosforowego i choliny.
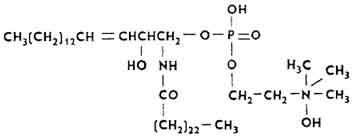
Często nazywane są sfingomielinami. Są bogate w tkankę nerwową (stanowią podstawę osłonek mielinowych włókien nerwowych), śledzionę, płuca, nerki i trzustkę. Czasami cząsteczka lipidu zawiera resztę dihydrosfingozyny. Fosfatydy sfingozyny to białe krystaliczne substancje, które tworzą wodny roztwór koloidalny. Wyższe kwasy tłuszczowe reprezentuje kwas stearynowy (50%), mniej lignocerowy i nerwowy. Stanowią 20% wszystkich lipidów mózgu.
Glikolipidy. Są to substancje tłuszczopodobne, których cząsteczki zawierają również składnik węglowodanowy.
Cerebrozydy. Są mieszaniną estrów zbudowanych z reszt sfingozyny, wyższych kwasów tłuszczowych i galaktozy. W cerebrozydach sfingozyna występuje w postaci cerebronu, związku z kwasem cerebronowym i galaktozą, kerazyny, związku z kwasem lignocerowym i galaktozą, oraz nervonu, związku z kwasem nerwonowym i galaktozą (patrz niżej).

W tkankach mózgu jest wiele cerebrozydów. Jako część cząsteczki śledziony zawierają reszty glukozy (glukocerebrozydy).
Cerebrozydy są ciałami stałymi, nie rozpuszczają się w wodzie, rozpuszczają się w eterze dietylowym i naftowym, pęcznieją podczas gotowania i rozkładają się po podgrzaniu do 200 °C. Pełnią w organizmie funkcje strukturalne i metaboliczne.
Gangliozydy. Cząsteczka gangliozydu zawiera średnio 40-43% galaktozy, 21% kwasu neuraminowego, 13% sfingozyny, 23-26% heksozoaminy, glukozy i kwasu stearynowego. Wiele lipidów w tkance nerwowej, narządach miąższowych, komórkach krwi. Gangliozydy - strukturalne składniki neuronów, neutralizują trucizny, uczestniczą w przewodzeniu impulsów nerwowych itp.
sulfatydy. Są to estry utworzone przez sfingozynę, kwas cerebronowy lub lignocerowy, galaktozę i kwas siarkowy.

Sulfatydy znajdują się w tkankach mózgu, wątroby, nerek, mięśni itp. Pojawiają się w moczu przy stwardnieniu mózgu.
acyloglicerole, lub neutralny lipidy są najczęstszą grupą lipidów występujących w przyrodzie. Związki te są estrami kwasów tłuszczowych i trójwodorotlenowych alkoholi glicerolu (glicerydów), w których jedna, dwie lub trzy grupy hydroksylowe glicerolu mogą być zestryfikowane, tworząc odpowiednio mono, di oraz triacyloglicerole:
Najczęściej występujące w przyrodzie są triacyloglicerole. Ponieważ wszystkie powyższe acyloglicerole nie zawierają grup jonowych, są klasyfikowane jako neutralny lipidy. Jeśli wszystkie trzy rodniki kwasowe należą do tego samego kwasu tłuszczowego, to takie triacyloglicerole nazywane są prostymi, ale jeśli należą do różnych kwasów tłuszczowych, to są mieszane.
Kwasy tłuszczowe tworzące triacyloglicerole determinują ich właściwości fizykochemiczne. Im więcej reszt krótkołańcuchowych i nienasyconych kwasów w lipidach, tym niższa temperatura topnienia i wyższa rozpuszczalność. Tak więc tłuszcze zwierzęce zawierają zwykle znaczną ilość nasyconych kwasów tłuszczowych, dzięki czemu pozostają stałe w temperaturze pokojowej. Tłuszcze, które zawierają wiele nienasyconych kwasów, będą w tych warunkach płynne; nazywane są olejami.
Większość tłuszczów zwierzęcych zawiera w różnych proporcjach estry kwasu palmitynowego, stearynowego, palmitooleinowego, oleinowego i linolenowego. Tłuszcz ludzki, który topi się w temperaturze 15°C, zawiera około 70% nienasyconych kwasów tłuszczowych i jest płynny w temperaturze ciała. Tłuszcze z różnych tkanek tego samego organizmu, podobnie jak oleje roślinne, mogą różnić się od siebie zarówno długością łańcuchów węglowodorowych, jak i stopniem nienasycenia.
Do scharakteryzowania właściwości tłuszczu stosuje się stałe lub liczby tłuszczu,- liczba kwasowa, liczba zmydlająca, liczba jodowa.
Wspólnym fragmentem strukturalnym wszystkich fosfoglicerydów jest kwas fosfatydowy (1,2-diacylo,3-fosfoglicerol).
Kwas fosfatydowy powstaje w organizmie podczas biosyntezy triacyloglicerolu i neroli oraz fosfoglicerydów jako wspólny metabolit pośredni; występuje w tkankach w niewielkich ilościach. Należy zauważyć, że wszystkie naturalne fosfoglicerydy należą do serii L. Różnorodny fosfoglicerydy różnią się od siebie dodatkowymi grupami przyłączonymi do kwasu fosfatydowego wiązaniem fosfoestrowym, tj. R3. Skład kwasów tłuszczowych różnych fosfoglicerydów jest różny nawet w obrębie tego samego organizmu i wraz z grupami podstawnikowymi decyduje o specyfice fosfolipidów:
Fosfatydylocholina (lecytyna). Zawiera aminoalkohol cholinę (wodorotlenek 3-hydroksyetylotrimetyloamoniowy):
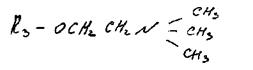 |
Fosfatydyloetanoloamina (kefalina). W skład fosfatydyloetanoloamin zamiast choliny wchodzi zasada azotowa etanoloamina HO-CH2-CH2-NH3.
Najwięcej fosfatydylocholiny i fosfatydyloetanoloaminy występuje w organizmie zwierząt i roślin wyższych. Te dwie grupy glicerofosfolipidów są głównymi składnikami lipidowymi błon komórkowych.
Fosfatydyloinozytole W przeciwieństwie do innych grup fosfoglicerydów, zamiast związków zawierających azot, fosfatydyloinozytol zawiera 6-węglowy cykliczny alkohol inozytol, reprezentowany przez jeden z jego stereoizomerów, monositol.
Fosfatydyloglicerole. Podobnie jak fosfatydyloinozytole, fosfatydyloglicerole nie zawierają związku zawierającego azot. W tych związkach inna cząsteczka glicerolu służy jako grupa polarna.
FIZYKO-CHEMICZNE WŁAŚCIWOŚCI LIPIDÓW
Lipidy to substancje bardzo niejednorodne w swojej budowie chemicznej, charakteryzujące się różną rozpuszczalnością w rozpuszczalnikach organicznych iz reguły nierozpuszczalne w wodzie. Odgrywają ważną rolę w procesach życiowych. Będąc jednym z głównych składników błon biologicznych, lipidy wpływają na ich przepuszczalność, uczestniczą w przekazywaniu impulsów nerwowych oraz tworzeniu kontaktów międzykomórkowych.
Inne funkcje lipidów to tworzenie rezerwy energii, tworzenie ochronnych powłok hydrofobowych i termoizolacyjnych u zwierząt i roślin oraz ochrona narządów i tkanek przed wpływami mechanicznymi. Frakcja lipidowa zawiera większość substancji, które przedstawiono w tabeli. Ze względu na niejednorodność składników wchodzących w skład frakcji lipidowej, termin „frakcja lipidowa” nie może być uważany za cechę strukturalną; jest to tylko robocza nazwa laboratoryjna dla frakcji uzyskanej podczas ekstrakcji materiału biologicznego rozpuszczalnikami niepolarnymi. Jednak większość lipidów ma pewne wspólne cechy strukturalne, które prowadzą do ważnych właściwości biologicznych i podobnej rozpuszczalności. Najczęściej spotykanymi lipidami są tłuszcze obojętne, których składnikiem strukturalnym, jak większość lipidów, są kwasy tłuszczowe.
NIEKTÓRE NATURALNE KWASY TŁUSZCZOWE
|
Liczba atomów węgla |
Struktura |
Nazwa systematyczna |
Nazwa trywialna |
|
Nasycone kwasy tłuszczowe |
|||
|
CH3 (CH2) 10 COOH |
n- Dodecanic |
Lauric |
|
|
CH3 (CH2) 12 COOH |
n- Tetradekanowy |
mirystyczne |
|
|
CH3 (CH2) 14 COOH |
n- Heksadekan |
palmitynowy |
|
|
CH3 (CH2) 16 COOH |
n- Oktadekaniczny |
Stearyc |
|
|
CH3 (CH2) 18 COOH |
n- eikozanoiczny |
arachinoiczny |
|
|
CH3 (CH2) 22 COOH |
n- Tetrakozanoiczny |
Lignoceryk |
|
|
nienasycone kwasy tłuszczowe |
|||
|
CH 3 (CH 2) 5 CH \u003d CH (CH 2) 7 COOH |
Palmitolej |
||
|
CH 3 (CH 2) 7 CH \u003d CH (CH 2) 7 COOH |
Oleic |
||
|
CH 3 (CH 2) 4 CH \u003d CHCH 2 CH \u003d CH (CH 2) 7 COOH |
linolowy |
||
|
CH 3 CH 2 CH \u003d CHCH 2 CH \u003d CHCH 2 CH \u003d CH (CH 2) 7 COOH |
linolenowy |
||
|
CH 3 (CH 2) 4 CH \u003d CHCH 2 CH \u003d CHCH 2 CH \u003d CHCH 2 CH \u003d (CH 2) 3 COOH |
Arachidoński |
||
Kwasy tłuszczowe – alifatyczne kwasy karboksylowe – znajdują się w organizmie w: wolny stan(ilości śladowe w komórkach i tkankach) lub służą jako elementy budulcowe dla większości klas lipidów.
Naturalne kwasy tłuszczowe, choć nieco arbitralnie, można podzielić na trzy grupy: kwasy tłuszczowe nasycone, jednonienasycone i wielonienasycone. Kwasy tłuszczowe znajdujące się w naturalnych lipidach na ogół zawierają parzystą liczbę atomów węgla i są przeważnie prostołańcuchowe.
Kwasy tłuszczowe wchodzące w skład lipidów zwierząt i roślin wyższych mają wiele wspólnych właściwości. Jak już wspomniano, prawie wszystkie naturalne kwasy tłuszczowe zawierają parzystą liczbę atomów węgla, najczęściej 16 lub 18. Nienasycone kwasy tłuszczowe zwierząt i ludzi biorących udział w budowie lipidów zwykle zawierają podwójne wiązanie między 9 a 10 atomem węgla; dodatkowe wiązania podwójne z reguły znajdują się w obszarze między 10. atomem węgla a metylowym końcem łańcucha. Osobliwością podwójnych wiązań naturalnych nienasyconych kwasów tłuszczowych jest to, że są one zawsze oddzielone dwoma proste połączenia, tj. między nimi zawsze znajduje się co najmniej jedna grupa metylenowa (-CH \u003d CH - CH 2 - CH \u003d CH -). Takie wiązania podwójne są określane jako „izolowane”. Naturalne nienasycone kwasy tłuszczowe mają cis-konfiguracja i niezwykle rzadkie trans-konfiguracja. Uważa się, że w nienasyconych kwasach tłuszczowych z kilkoma wiązaniami podwójnymi cis-konfiguracja nadaje łańcuchowi węglowodorowemu zakrzywiony i skrócony wygląd, co ma sens biologiczny (szczególnie biorąc pod uwagę, że wiele lipidów jest częścią błon).
Kwasy tłuszczowe o długim łańcuchu węglowodorowym są praktycznie nierozpuszczalne w wodzie. Ich sole sodowe i potasowe (mydła) tworzą micele w wodzie. W tym ostatnim ujemnie naładowane grupy karboksylowe kwasów tłuszczowych skierowane są do fazy wodnej, podczas gdy niepolarne łańcuchy węglowodorowe są ukryte w strukturze micelarnej. Takie micele mają całkowity ładunek ujemny i pozostają zawieszone w roztworze z powodu wzajemnego odpychania.
TEMAT. jeden.WŁAŚCIWOŚCI FIZYKOCHEMICZNETŁUSZCZE NEUTRALNE
(Godzina ósma)
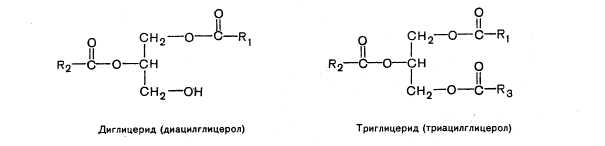
Tłuszcze obojętne to estry glicerolu i kwasów tłuszczowych. Jeśli wszystkie trzy grupy hydroksylowe glicerolu są zestryfikowane kwasami tłuszczowymi (rodniki acylowe R1, R2 i R3 mogą być takie same lub różne), to taki związek nazywamy triglicerydem
Gliceryna (glicerol) Monogliceryd (monoacyloglicerol)
(triacyloglicerol), jeśli dwie - digliceryd (diacyloglicerol) i wreszcie, jeśli jedna grupa jest eteryfikowana - monogliceryd (monoacyloglicerol).
Digliceryd (diacyloglicerol) Trigliceryd (triacyloglicerol)
Tłuszcze obojętne występują w organizmie albo w postaci tłuszczu protoplazmatycznego, który jest składnikiem strukturalnym komórek, albo w postaci tłuszczu rezerwowego, zapasowego. Rola tych dwóch form tłuszczu w organizmie nie jest taka sama. Tłuszcz protoplazmatyczny ma stały skład chemiczny i jest zawarty w tkankach w określonej ilości, która nie zmienia się nawet przy olbrzymiej otyłości, natomiast ilość tłuszczu zapasowego podlega dużym wahaniom.
Większość naturalnych tłuszczów obojętnych to trójglicerydy. Kwasy tłuszczowe w triglicerydach mogą być nasycone lub nienasycone. Najpopularniejszymi kwasami tłuszczowymi są kwas palmitynowy, stearynowy i oleinowy. Jeśli wszystkie trzy rodniki kwasowe należą do tego samego kwasu tłuszczowego, wówczas takie triglicerydy nazywane są prostymi (na przykład tripalmityna, tristearyna, trioleina itp.), Ale jeśli należą do różnych kwasów tłuszczowych, są one mieszane. Nazwy mieszanych triglicerydów pochodzą od ich składowych kwasów tłuszczowych; natomiast liczby 1, 2 i 3 wskazują na związek reszty kwasu tłuszczowego z odpowiednią grupą alkoholową w cząsteczce glicerolu (na przykład 1-oleo-2-palmitostearyna).
Kwasy tłuszczowe wchodzące w skład triglicerydów praktycznie determinują ich właściwości fizykochemiczne. Tak więc temperatura topnienia triglicerydów wzrasta wraz ze wzrostem liczby i długość reszt nasyconych kwasów tłuszczowych . Natomiast im wyższa zawartość nienasyconych kwasów tłuszczowych lub kwasów krótkołańcuchowych, tym niższa temperatura topnienia. Tłuszcze zwierzęce (smalec) zazwyczaj zawierają znaczną ilość nasyconych kwasów tłuszczowych (palmitynowego, stearynowego itp.), dzięki czemu w temperaturze pokojowej są stałe. Tłuszcze, które zawierają dużo kwasów jedno- i wielonienasyconych, w zwykłych temperaturach są płynne i nazywane są olejami. Tak więc w oleju konopnym 95% wszystkich kwasów tłuszczowych to kwasy oleinowy, linolowy i linolenowy, a tylko 5% to kwasy stearynowy i palmitynowy. Należy pamiętać, że tłuszcz ludzki, topniejący w temperaturze 15 ° C (jest płynny w temperaturze ciała), zawiera 70% kwasu oleinowego.
Glicerydy są w stanie wejść we wszystkie reakcje chemiczne związane z estrami. Najważniejsza jest reakcja zmydlania, w wyniku której z trójglicerydów powstaje glicerol i kwasy tłuszczowe. Zmydlanie tłuszczu może wystąpić zarówno podczas hydrolizy enzymatycznej, jak i pod działaniem kwasów lub zasad.
Laboratorium #40
EDUKACJAMIEJSCE OLEJU
Postęp
Kroplę oleju nanosi się szklanym prętem na kartkę papieru. Powstaje plama, która nie znika po podgrzaniu.
Laboratorium #41
ROZPUSZCZALNOŚĆ W TŁUSZCZACH
Odczynniki: olej roślinny (słonecznikowy, lniany, bawełniany lub inny)
Tłuszcz stały (jagnięcina, wołowina)
eter dietylowy, aceton
Etanol
Postęp
Umieść dwa rzędy probówek po 4 w każdym. Do probówek pierwszego rzędu dodaje się kilka kropel oleju roślinnego, a do probówek drugiego rzędu dodaje się kawałek stałego tłuszczu. Do pierwszej probówki każdego rzędu wlać 2 ml wody destylowanej, do drugiej taką samą ilość eteru dietylowego, do trzeciej acetonu, do czwartej alkoholu. Wszystkie probówki są wstrząsane i obserwuje się rozpuszczalność tłuszczów w różnych rozpuszczalnikach. Probówki z alkoholem zaleca się podgrzewać w kąpieli wodnej. Zapisz wyniki eksperymentu.
|
Wariant doświadczenia |
probówki |
Użyte odczynniki (ml) |
Stopień rozpuszczalności |
|||
|
Olej roślinny |
||||||
Wyciągnij wniosek:
Laboratorium #42
EMULGOWANIE OLEJÓW TŁUSZCZOWYCH
Reakrodzaje: Olej roślinny
Węglan sodu, 2% roztwór
Mydło, 2% roztwór
Postęp
Dodaj 5 kropli oleju do czterech probówek. Do pierwszej probówki dodaje się 2 ml wody destylowanej, do drugiej 2 ml 2% roztworu węglanu sodu (sody), do trzeciej taką samą ilość 2% roztworu mydła, 2 ml wody i kilka kropli żółci do czwartego. Wszystkie probówki zostają wstrząśnięte i w pierwszej probówce powstaje niestabilna emulsja typu olej w wodzie, która szybko rozdziela się podczas stania, a w pozostałych - stabilna emulsja dzięki działaniu dodanych emulgatorów, które są adsorbowane na zewnątrz warstwy kropelek tłuszczu i obniżają ich napięcie powierzchniowe.
Zapisz wynik eksperymentu w tabeli:
|
probówki |
Użyte odczynniki (ml) |
Charakter emulsji |
||||
|
warzywo |
H 2 O + żółć |
|||||
|
ALE Również studenci medyczny uniwersytety Ukraina. metodyczny instrukcje sporządzony profesor nadzwyczajny. Fedorko NL, profesor nadzwyczajny. Zahariewa Z.E., profesor nadzwyczajny. Wowczuk... Analiza bezpieczeństwa w sytuacjach awaryjnych przedszpitalnej opieki medycznej ofiarom wypadków drogowych z obrażeniami w arktycznej strefie obwodu archangielskiegoDokumentlekarz, studenci humanitarne i medyczny specjalności określiły, że lekarz powinien być wysoce wykwalifikowany specjalista, posługiwać się zaawansowane metody... L. N. Viktorova kandydat nauk prawnych, doc. 21 (współautor)Dokument... na czeki apteczne i inni medyczny instytucje, dla osób zajmujących się rzemiosłem medyczny przepisy kulinarne... być może być czas wystąpienia takich skutków jest ustalony, który dowiedzieliśmy się w trakcie śledztwa, przy pomocy specjalista. Określony ... L. S. Volkova i Honorowy Pracownik Wyższej Szkoły Federacji Rosyjskiej, profesor (1)DokumentWięc co na uszkodzenie obu inne wytwarza tylko afazję, być może być, kształt, w który ekspresowe... i medyczny instytucje. W związku z faktem, że studenci wydziały oligofrenopedagogiki otrzymują podczas szkolenia w Uniwersytet Również i logopedii... I. A. Altman (redaktor naczelny), A. E. Gerber, Yu. A. Dombrovsky, Yu. I. Kanner, B. N. Kovalev, G. V. Kostyrchenko, Dr. Tamas Kraus (Węgry), A. I. Kruglov (Ukraina), DI Połtorak, ES Rosenblat (Białoruś), LADokumentDo specjalistów systemy edukacji – menedżerowie, nauczyciele, psychologowie, pedagodzy społeczni, medyczny pracownicy edukacyjni instytucje, a Również ... | ||||||
Pojęcia ogólne.
Tłuszcze to estry glicerolu i kwasów tłuszczowych o dużej masie cząsteczkowej.
Tłuszcze składają się z wielu nasyconych (lub nasyconych) i nienasyconych (lub nienasyconych) kwasów tłuszczowych. Wśród kwasów nasyconych bardziej powszechne są stearynowy (C17H35COOH) i palmitynowy (C15H31COOH). Spośród nienasyconych kwasów tłuszczowych główną rolę odgrywają kwas oleinowy (C17H33COOH), linolowy (C17H31COOH) i linolenowy (C17H29COOH), duża znaczenie fizjologiczne zawiera również kwas arachidonowy (С19Н31СООН). Nienasycone kwasy tłuszczowe charakteryzują się obecnością wiązań podwójnych: cząsteczka kwasu oleinowego zawiera jedno wiązanie podwójne, cząsteczka kwasu linolowego ma dwa, kwas linolenowy trzy, a kwas arachidonowy cztery. Ze względu na obecność wiązań podwójnych nienasycone kwasy są wysoce reaktywne. Kwasy linolowy, linolenowy i arachidonowy (tzw. jolinenazynowy) nie są syntetyzowane w organizmie człowieka i muszą być dostarczane z pożywieniem. Brak tych kwasów w pożywieniu powoduje poważne zaburzenia metaboliczne, które ustępują przy spożywaniu produktów zawierających nienasycone kwasy tłuszczowe. Dlatego związki te zaliczane są do substancji o działaniu witaminowym (witamina F). Kwasy linolowy i linolenowy znajdują się w olejach roślinnych (siemieniu lnianym, słonecznikowym itp.), kwas arachidonowy znajduje się w olejach z wątroby ryb, maśle i niektórych rodzajach margaryny.
W składzie olejków niektórych roślin tropikalnych znajdują się również cykliczne kwasy tłuszczowe (chaulmugro, hydrokarp itp.).
Jakościowe reakcje na tłuszcze.
Powstawanie plam olejowych. Kroplę oleju nanosi się szklanym prętem na kartkę papieru. Powstaje plama, która nie znika po podgrzaniu.
Rozpuszczalność tłuszczów. Odczynniki: a) olej roślinny(słonecznik, len, bawełna lub inne); b) tłuszcz stały (baranina, wołowina); c) eter dietylowy; d) aceton; e) alkohol etylowy; e) woda destylowana.
Umieść dwa rzędy probówek po 4 w każdym. Do probówek pierwszego rzędu dodaje się kilka kropel oleju roślinnego, a do probówek drugiego rzędu dodaje się kawałek stałego tłuszczu. Do pierwszej probówki każdego rzędu wlać 2 ml wody destylowanej, do drugiej taką samą ilość eteru dietylowego, do trzeciej acetonu, do czwartej alkoholu. Wszystkie probówki są wstrząsane i obserwuje się rozpuszczalność tłuszczów w różnych rozpuszczalnikach. Probówki z alkoholem zaleca się podgrzewać w kąpieli wodnej. Zapisz wyniki eksperymentu.
emulgowanie tłuste oleje. Odczynnikowy olej roślinny; b) węglan sodu, 2% roztwór; c) mydło, roztwór 2%; d) żółć; e) woda destylowana.
Dodaj 5 kropli oleju do czterech probówek. Do pierwszej probówki dodać 2 ml wody destylowanej, do drugiej 2 ml 2% roztworu węglanu sodu (sody), do trzeciej taką samą ilość 2% roztworu mydła, do czwartej wody i kilka kropli żółci. Wszystkie probówki zostają wstrząśnięte i w pierwszej probówce powstaje niestabilna emulsja typu olej w wodzie, która szybko rozdziela się podczas stania, a w pozostałych - stabilna emulsja dzięki działaniu dodanych emulgatorów, które są adsorbowane na zewnątrz warstwy kropelek tłuszczu i obniżają ich napięcie powierzchniowe.
reakcja akroleiny. Za pomocą testu na akroleinę określa się obecność glicerolu w tłuszczach. Gdy tłuszcz jest podgrzewany kwaśnym siarczanem potasu, sodu lub kwasem borowym, dwie cząsteczki wody odrywają się od cząsteczki glicerolu, a aldehyd akrylowy lub akroleina ma ostry, drażniący zapach (spalonego tłuszczu):
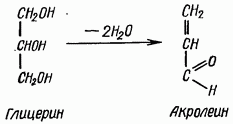
Gliceryna Akroleina
Odczynniki: a) olej roślinny lub tłuszcz zwierzęcy; b) wosk pszczeli; c) kwaśny siarczan potasu lub sodu, krystaliczny; d) kwas borowy, krystaliczny.
Do suchej probówki dodaje się kilka kropel oleju roślinnego lub kawałek tłuszczu zwierzęcego, dodaje się trochę proszku kwaśnego siarczanu potasu (lub sodu) lub kwas borowy i delikatnie rozgrzej. Pojawiają się białe opary akroleiny o ostrym zapachu. Reakcja z woskiem się powtarza - akroleina nie powstaje, ponieważ glicerol nie wchodzi w skład wosków.
Zmydlanie tłuszczu. Gdy tłuszcze wchodzą w interakcję z zasadami, ulegają hydrolizie, tworząc sole wyższych kwasów tłuszczowych (mydło) i glicerynę. Sole sodowe są mydłami stałymi, sole potasowe są płynne. Reakcja przebiega zgodnie z równaniem
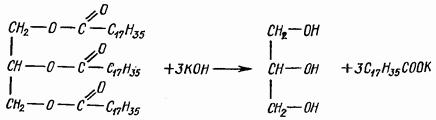
Odczynniki: a) olej roślinny lub tłuszcz zwierzęcy; b) wodorotlenek potasu, 30% roztwór alkoholu; c) woda destylowana.
Do szerokiej probówki dodać 0,5 ml oleju roślinnego lub około 0,5 g tłuszczu zwierzęcego i dodać 10 ml roztwór alkoholu potaż żrący. Rurkę zatyka się chłodnicą powietrza i ogrzewa we wrzącej łaźni wodnej przez 30 minut, po czym do rurki wlewa się gorącą wodę i rozpuszcza się w niej mydło.
Izolacja wolnych kwasów tłuszczowych. Odczynniki: a) roztwór mydła (patrz poprzednia praca); b) kwas solny (1:1 objętościowo).
Do 5 ml roztworu mydła dodaj 1-2 ml roztworu kwasu solnego. Kiedy silny kwas reaguje z mydłem, uwalniane są wolne kwasy tłuszczowe, które unoszą się na powierzchni cieczy. Reakcja przebiega zgodnie z następującym równaniem:
Tworzenie nierozpuszczalnych mydeł. Sole wapniowe i magnezowe kwasów tłuszczowych są nierozpuszczalne w wodzie.
Odczynniki: a) roztwór mydła (patrz praca „Zmydlanie tłuszczu”); b) chlorek wapnia, roztwór 5-10%.
Do 2-3 ml roztworu mydła potasowego dodać 1 ml roztworu chlorku wapnia. Wytrąca się nierozpuszczalny w wodzie osad stearynianu wapnia
Test na nienasycone kwasy tłuszczowe. Nienasycone kwasy tłuszczowe są w stanie dodać halogenki w miejscu podwójnych wiązań:

Odczynniki: a) olej roślinny; b) woda bromowa (przechowywana w przeciągu!); c) eter dietylowy lub chloroform.
Do probówki wlać 1-2 ml oleju, rozpuścić w 2-3 ml eteru dietylowego lub chloroformu, dodać 1-2 krople wody bromowej i wstrząsnąć. Znika brązowo-żółty kolor wody bromowej, co wskazuje na obecność kwasów nienasyconych.
Kwantyfikacja tłuszczu. Liczne metody oznaczania zawartości tłuszczu w materiale biologicznym opierają się na zdolności lipidów do rozpuszczania się w rozpuszczalnikach organicznych (eter dietylowy i naftowy, tetrachlorek
węgiel, dichloroetan, chloroform itp.). Po ekstrakcji rozpuszczalnikami organicznymi do roztworu przechodzą nie tylko tłuszcze, ale także wolne kwasy tłuszczowe, fosfolipidy, sterole, woski, olejki eteryczne, pigmenty (na przykład chlorofil) i szereg innych substancji, dlatego otrzymany w wyniku produkt analizy nazywa się „tłuszczem surowym” lub „suma lipidów”. Dla celów praktycznych wskaźnik ten jest zwykle wystarczający, ale w przypadku konieczności dokładniejszego określenia „prawdziwego tłuszczu” konieczne jest zbadanie zawartości fosfolipidów (pod względem fosforu) w poszczególnych próbkach materiału, olejki eteryczne(destylacja z parą wodną), wolne kwasy tłuszczowe (metoda miareczkowa) itp. oraz wprowadzić odpowiednie poprawki do wyników analizy.
Oto metoda oznaczania „tłuszczu surowego” w nasionach oleistych (według S. V. Rushkovsky'ego), która znalazła szerokie zastosowanie w praktyce laboratoryjnej.
Odczynniki i materiały; a) eter dietylowy. Do ekstrakcji tłuszczu stosuje się eter bezwodny. Kalcynowany chlorek wapnia lub wapno palone (tlenek wapnia) dodaje się do kolby z handlowym eterem. Naczynie zamyka się korkiem, do którego wkłada się rurkę z kalcynowanym chlorkiem wapnia. Po 1-2 dniach eter spuszcza się i dodaje do niego nową porcję wapna palonego lub chlorku wapnia. Po 6-8 godzinach eter wlewa się do naczynia, na dnie którego umieszcza się kawałki metalicznego sodu. Eter musi być również wolny od nadtlenków. Aby to zrobić, dodaj roztwór do 1 litra eteru nadmanganian potasu i 10 ml 40% roztworu potażu kaustycznego lub sody kaustycznej, mieszaninę delikatnie wstrząsa się i umieszcza w ciemnym miejscu na 20-24 godziny, po czym rozdziela się w rozdzielaczu. Dolną warstwę wodną oddziela się, a górną warstwę eterową przemywa się kilkakrotnie wodą destylowaną, a następnie odwadnia, jak opisano powyżej. Uwaga! Eter dietylowy jest wysoce łatwopalny, jego opary tworzą z powietrzem mieszaniny wybuchowe, dlatego wszystkie prace należy wykonywać z zachowaniem ścisłej ochrony przeciwpożarowej. Wskazane jest zastąpienie eteru dietylowego niepalnym rozpuszczalnikiem, takim jak czterochlorek węgla lub chloroform;
b) dwupodstawiony fosforan sodu bezwodny lub siarczan sodu bezwodny. kryształowa sól suszony przez 6-8 godzin w temperaturze 100-105 ° C. Siarczan sodu kalcynuje się w piecu muflowym na len, konopie, słonecznik, rzepak, nasiona sezamu.
Ryż. 11. Aparat do ekstrakcji Soxhleta.
Aparatura: a) Aparat do ekstrakcji Soxhleta (ryc. 11). Składa się z trzech zmielonych ze sobą części: chłodnicy kulowej lub spiralnej 1, ekstraktora 2 i kolby odbiorczej 3.
Pobrać 2-3 próbki nasion ale 2-5 g (w zależności od oczekiwanej zawartości oleju). Próbkę przenosi się do suchego moździerza porcelanowego i miele bezwodnym siarczanem sodu lub dipodstawionym fosforanem sodu do uzyskania jednorodnej masy proszku. Sole pobierają trzy razy więcej w stosunku do próbki.
Starannie zmieloną masę przenosi się ilościowo do worka z bibuły filtracyjnej wysuszonej do stałej masy. Worek owija się jak proszek w aptece, waży na wadze analitycznej i przenosi do ekstraktora aparatu Soxhleta.
Notatka. W ekstraktorze można umieścić 4-6 saszetek.
Eter (lub inny rozpuszczalnik) wlewa się do kolby odbiorczej na pojemniki, po czym łączy się z ekstraktorem. Do ekstraktora wlewa się tyle eteru, że jego poziom przykrywa saszetki i sięga prawie szczytu syfonu, następnie cienkim odcinkiem łączy się go z lodówką, a aparat umieszcza się w zimnej łaźni wodnej. Materiał jest podawany w rozpuszczalniku
co najmniej 3-4 godziny i dopiero po tym włącz źródło ogrzewania.
Notatka. Urządzenia Soxhleta powinny być instalowane w dygestorium. Jeszcze raz podkreślamy potrzebę starannego przestrzegania wszelkich środków przeciwpożarowych. Podczas napełniania eteru wszystkie urządzenia elektryczne w laboratorium są wyłączone.
Pary eteru z kolby odbiorczej przez szeroką rurkę trafiają do lodówki, gdzie ulegają kondensacji, a krople rozpuszczalnika wpływają do ekstraktora, odciągając tłuszcz z rozdrobnionych nasion. Jak tylko poziom eteru osiągnie górna krawędź rurka syfonowa, natychmiast zacznie przelewać się do kolby odbiorczej. W ten sposób proces ekstrakcji trwa nieprzerwanie. Eter dietylowy wrze w temperaturze 34-35 ° C, dlatego konieczne jest dostosowanie ogrzewania tak, aby nie więcej niż 8-10 odpływów rozpuszczalnika przez rurkę syfonu nastąpiło w ciągu godziny.
Ekstrakcję tłuszczu kontynuuje się przez 5-6 godzin (nie licząc czasu wlewu), po czym saszetki z materiałem beztłuszczowym wyjmuje się z ekstraktora, suszy na szkle pod wyciągiem (do odparowania eteru) i suszy (w zważone butelki) w temperaturze 100-105°C do stałej wagi. Zawartość oleju w nasionach (jako procent suchej masy) oblicza się znając wagę saszetki przed i po ekstrakcji, a także wagę pustej saszetki. Weź średnią z 3-4 oznaczeń.
Oznaczanie wskaźników chemicznych tłuszczów.
Skład tłuszczów naturalnych jest bardzo niejednorodny. Składają się z mieszaniny trójglicerydów różnych nasyconych i nienasyconych kwasów tłuszczowych. Ponadto zawierają również mono- i diglicerydy, wolne kwasy tłuszczowe, pigmenty, witaminy rozpuszczalne w tłuszczach oraz pewną domieszkę substancji białkowych. Tłuszczom obojętnym zwykle towarzyszą lipidy (fosfatydy, sterole, sterydy itp.).
Tłuszcze roślinne (potocznie nazywane olejami) charakteryzują się płynną konsystencją. Składają się głównie z kwasów nienasyconych. Masło kakaowe i olej kokosowy są stałe.
Tłuszcze pochodzenia zwierzęcego są w przeważającej części stałe, ponieważ składają się głównie z glicerydów nasyconych kwasów tłuszczowych. Płynne tłuszcze zwierzęce
Tłuszcze charakteryzują się szeregiem wskaźników chemicznych. Główne z nich to: liczba kwasowa, liczba zmydlania, liczba eterowa, liczba jodowa.
Notatka. Więcej szczegółowa charakterystyka właściwości chemiczne Zhnrov określa również zawartość kwasów lotnych (rozpuszczalnych i nierozpuszczalnych w wodzie), hydroksykwasów (liczba acetylowa), liczby rodanowej i heksabromowej oraz niektórych innych wskaźników, których rozważenie nie jest objęte zadaniami naszego warsztatu.
Tłuszcz magazynowany pod wpływem tlenu atmosferycznego, wilgoci i światła słonecznego, przy udziale organicznych katalizatorów enzymatycznych, ulega zepsuciu, jełczeniu. Oleje roślinne, bogate w nienasycone kwasy, jełczeją szybciej niż tłuszcze stałe. Stopień stabilności tłuszczów podczas przechowywania charakteryzuje się liczbą nadtlenkową oraz zawartością aldehydów. W dużej mierze świadczy o tym również liczba kwasowa, gdyż podczas psucia następuje hydrolityczny rozkład trójglicerydów i uwalnianie wolnych kwasów tłuszczowych.
Liczba kwasowa. Liczba kwasowa to liczba miligramów kaustycznego potasu potrzebna do zneutralizowania wolnych kwasów tłuszczowych zawartych w 1 g tłuszczu.
Odczynniki: a) potaż żrący, 0,1 N roztwór alkoholu;
b) mieszanina alkoholu etylowego z eterem dietylowym (1:1);
c) fenoloftaleina, 1% roztwór alkoholu; d) tymol-ftaleina, 1% roztwór alkoholu.
Do suchej kolby stożkowej (pojemność 250 ml) odważ 3-5 g tłuszczu. Próbkę rozpuszcza się w 50 ml uprzednio zobojętnionej mieszaniny alkoholu i eteru.
Notatka. Mieszaninę alkoholu i eteru neutralizuje się 0,1 N alkoholowym roztworem sody kaustycznej (w obecności 3-4 kropli roztworu fenoloftaleiny) do lekko różowego koloru i dopiero potem wlewa się do kolby z próbką zhnra.
Roztwór tłuszczu miareczkuje się 0,1 N alkoholowym roztworem kaustycznego potasu (wskaźnik - fenoloftaleina) do pojawienia się różowego zabarwienia, które nie znika w ciągu 0,5-1 min.
Przy określaniu liczby kwasowej ciemnych tłuszczów zamiast fenoloftaleiny stosuje się 1% alkoholu.
roztwór tymolftaleiny (bezbarwny w środowisku kwaśnym, niebieski w środowisku zasadowym).
Liczba kwasowa k.h. jest obliczana ze wzoru
![]()
gdzie w - ilość 0,1 n roztworu alkoholu kaustycznego potażu, wydanego na miareczkowanie próbki tłuszczu, ml; k - współczynnik korygujący do miana 0,1 n roztworu KOH; 5,611 - miano dokładnie 0,1 N roztworu KOH; n - waga tłuszczu, g.
Aby scharakteryzować kwasowość olejów roślinnych, oprócz liczby kwasowej, procent wolnego kwasu oleinowego O często oblicza się ze wzoru
![]()
gdzie k.h. to liczba kwasowa oleju, mg.
Numer zmydlania. Liczba zmydlania pokazuje, ile miligramów potażu żrącego należy zużyć, aby zneutralizować zarówno wolne, jak i związane (estrowe) kwasy zawarte w 1 g tłuszczu.
Odczynniki: a) olej roślinny lub tłuszcz zwierzęcy; b) potas kaustyczny, 0,5 N roztwór alkoholu: 29-30 g granulowanego potażu kaustycznego rozpuszcza się w 25-30 ml wody, po czym kilka mililitrów 35-40% roztworu chlorku baru i roztwór w objętości litra Do kolby dodaje się w celu wytrącenia węglany rozcieńczyć alkoholem etylowym - rektyfikować do kreski. Przechowywać w dobrze zakorkowanej butelce ze szkła pomarańczowego. W celu ochrony przed wnikaniem atmosferycznego dwutlenku węgla do kolby dołączona jest rurka chlorku wapnia z wapnem sodowanym; c) kwas solny, roztwór 0,5 N; d) fenoloftaleina, roztwór alkoholu.
Kolbę stożkową (pojemność 250 ml) waży się na wadze analitycznej, następnie dodaje się do niej około 2 g oleju roślinnego lub tłuszczu zwierzęcego i ponownie waży. Przez różnicę ustala się wagę tłuszczu. Do kolby wlać 25 ml 0,5 N alkoholowego roztworu KOH za pomocą pipety z gumową gruszką, zatkać chłodnicą zwrotną i ogrzewać w łaźni wodnej przez 35-40 minut, co jakiś czas wstrząsając zawartością kolby . Podczas zmydlania tłuszczu nie należy dopuszczać do przemocy
wrzącej wody w wannie, co może spowodować spienienie płynu w kolbie i przedostanie się na korek. Pod koniec procesu zmydlania roztwór w kolbie staje się jednorodny, przezroczysty, bez kropelek tłuszczu.
Gorący roztwór mydła miareczkować w kolbie 0,5 N kwasem chlorowodorowym (wskaźnik - fenoloftaleina) aż do zniknięcia różowego koloru. Równolegle przeprowadza się eksperyment kontrolny z taką samą ilością 0,5 N alkoholowego roztworu KOH, ale bez dodatku tłuszczu. W celu sprawdzenia miana roztworu KOH konieczne jest przeprowadzenie eksperymentu kontrolnego, ponieważ miano może ulec zmianie na skutek częściowej penetracji dwutlenku węgla z powietrza i utlenienia alkoholu etylowego.
Numer zmydlania około. obliczona według wzoru
![]()
gdzie c oznacza ilość 0,5 n roztworu kwasu chlorowodorowego użytego do miareczkowania w doświadczeniu kontrolnym („ślepym”), ml; - ilość 0,5 N roztworu kwasu solnego użytego do miareczkowania badanej próbki, k - współczynnik korygujący do miana ok. 0,5 N alkoholowego roztworu KOH; 28,055 - miano dokładnego 0,5 N roztworu KOH (1 ml roztworu zawiera 28,055 mg KOH); n - waga tłuszczu, g.
Numer eterowy. Liczba estrowa to liczba miligramów wodorotlenku potasu potrzebna do zneutralizowania kwasów tłuszczowych związanych jako estry w 1 g tłuszczu.
Eter numer mi. h. określa się na podstawie obliczeń, odejmując liczbę kwasową od liczby zmydlania:
Tak więc liczba zmydlania jest sumą liczby kwasowej i estrowej.
Oznaczanie zawartości glicerolu w tłuszczu.
Chemiczne oznaczanie zawartości glicerolu w tłuszczach jest dość pracochłonne i długotrwałe. Stosunkowo dobre wyniki uzyskuje się metodą obliczeniową. Znając niezbędną ilość tłuszczu, można obliczyć zawartość glicerolu, biorąc pod uwagę, że do uwolnienia jednej cząsteczki glicerolu należy zużyć trzy cząsteczki kaustycznego potasu.
Procent glicerolu w tłuszczu g oblicza się według wzoru
![]()
gdzie 92,06 to masa cząsteczkowa glicerolu; mi. godziny - niezbędna ilość tłuszczu; 56,11 - masa cząsteczkowa potażu żrącego.
Liczba jodowa.
Informacje ogólne. Liczba jodowa wskazuje, ile gramów jodu dodaje się do 100 g tłuszczu. Wskazuje ilościową zawartość kwasów nienasyconych w tłuszczu, co pozwala ocenić jego odporność na utlenianie, polimeryzację i inne przemiany. Liczba jodowa jest wskaźnikiem charakterystycznym dla każdego rodzaju świeżego tłuszczu.
Chemia procesu addycji halogenu jest opisana powyżej (patrz „Test na nienasycone kwasy tłuszczowe”). Należy podkreślić, że jod przyłącza się głównie do wiązań podwójnych, natomiast bardziej reaktywne halogenki – chlor i brom – mogą również zastąpić atomy wodoru w rodniku węglowodorowym kwasu.
Najdokładniejsze jest określenie liczby jodowej do Gjubliu, jednak wiąże się to z użyciem bardzo toksycznego odczynnika - sublimacyjnego i dlatego nie może być zalecane do praktycznej pracy studentów. Opisujemy prostsze szybka metoda określenie liczby jodowej, której stosowanie nie jest związane ze stosowaniem sublimacji. Metoda ma dość zadowalającą dokładność.
Oznaczanie liczby jodowej bromkiem jodu (wg Hanusa). Bromek jodu powstaje w wyniku oddziaływania jodu z bromem w środowisku kwasu octowego.
Bromek jodu dodaje się ilościowo do nienasyconych kwasów tłuszczowych w miejscu podwójnych wiązań.
Nadmiar nieuwzględnionego w reakcji bromku jolu reaguje z jodkiem potasu zgodnie z równaniem
Uwolniony jod jest miareczkowany tiosiarczanem.
Odczynniki: a) olej roślinny; b) Odczynnik Hanusa: 13 g krystalicznego jodu rozpuszcza się w 100 ml lodowatego kwasu octowego (w kolbie miarowej o pojemności 8,2 g bromu dodaje się do roztworu i doprowadza do 1 litra lodowatym kwasem octowym. Przechowywać w butelka ze szkła pomarańczowego ze szlifowanym korkiem Przygotowuje się roztwór asystenci laboratoryjni (pod wyciągiem!) c) jodek potasu, roztwór 20%. Przygotowany bezpośrednio przed definicją; d) tiosiarczan sodu (podsiarczyn, siarczan sodu), roztwór 0,1 n; e) skrobia, 1% roztwór; e) chloroform.
W suchej kolbie stożkowej lub kolbie ze zmielonym korkiem o pojemności 250-300 ml odważa się na wadze analitycznej 0,2-0,3 g oleju i rozpuszcza w 10 ml chloroformu. 10 ml chloroformu bez oleju dodaje się do innej podobnej kolby lub kolby („ślepy eksperyment”) 25 ml odczynnika Hanusa dodaje się do obu kolb z biurety (ze szklanym kranem). Naczynia szczelnie zamyka się korkami nasączonymi roztworem jodku potasu. Zawartość naczyń delikatnie wstrząsnąć, po czym naczynia umieścić w ciemnym miejscu na 1-1,5 h. roztworem tiosiarczanu sodu do lekko żółtego koloru, następnie dodać 10-12 kropli roztworu skrobi i kontynuować miareczkowanie do uzyskania roztworu całkowicie odbarwione.
Przy obliczaniu bierze się pod uwagę, że 1 ml 0,1 N roztworu tiosiarczanu sodu odpowiada 1 ml 0,1 N roztworu jodu. Liczba jodowa godziny są obliczane według wzoru
gdzie c to ilość 0,1 n roztworu tiosiarczanu użytego do miareczkowania próbki kontrolnej („ślepy eksperyment”), to ilość 0,1 n roztworu tiosiarczanu,
zużyty podczas miareczkowania prototypu, k - współczynnik korygujący do miana około 0,1 N roztworu tiosiarczanu; 0,01269 - miano roztworu tiosiarczanu jodu; n - waga oleju, g.
liczba nadtlenkowa.
Informacje ogólne. Nienasycone kwasy tłuszczowe łatwo się utleniają. Proces ten przebiega pod wpływem tlenu atmosferycznego, wilgoci, światła i jest katalizowany przez enzym lipooksygenazę (lipoksydazę).
Nadtlenki są związkami nietrwałymi. Łatwo rozkładają się z tworzeniem tlenków i uwalnianiem tlenu atomowego. Z kolei tlen atomowy służy jako źródło powstawania ozonu i nadtlenku wodoru.
Następnie nadtlenki i tlenki są przekształcane w hydroksykwasy.
Uwolniony ozon utlenia nowe cząsteczki kwasów nienasyconych. Tworzą się niestabilne związki, ozonki, które ulegają hydrolitycznemu rozszczepieniu zamieniając się w aldehydy.
Dlatego oznaczenie zawartości nadtlenków i aldehydów może być bardzo pomocne w ocenie jakości oleju roślinnego.
Oznaczanie liczby nadtlenkowej. Ilościowe oznaczanie nadtlenków w oleju roślinnym opiera się na reakcji uwalniania jodu przez nadtlenki z jodku potasu w środowisku kwaśnym
Jod jest miareczkowany roztworem tiosiarczanu.
Odczynniki: a) olej roślinny (najlepiej zjełczały); b) kwas octowy, lodowaty; c) chloroform, czysty chemicznie (lepiej - do znieczulenia); d) jodek potasu, roztwór nasycony. Przygotowany przed użyciem; e) tiosiarczan sodu (podsiarczyn, siarczan sodu), roztwór 0,002 N. Przygotowany przed użyciem z 0,1 N roztworu: 5 ml 0,1 N roztworu dodaje się do 250 ml kolby miarowej za pomocą pipety i
rozcieńczyć do kreski przegotowaną (a następnie schłodzoną do 20°C) wodą destylowaną; f) skrobia, roztwór 0,5%.
Odważa się (na wadze analitycznej) około 2 g oleju w kolbie stożkowej lub kolbie ze szlifowanym korkiem o pojemności 200 ml. Próbkę rozpuszcza się w 20 ml mieszaniny lodowatego kwasu octowego i chloroformu (2:1 objętościowo), dodaje się 5 ml nasyconego roztworu jodku potasu, naczynie zakorkowuje się i umieszcza w ciemnym miejscu na 10 minut, po czym dodaje się 50 ml wody destylowanej i uwolniony 0,002 n roztwór jodu tiosiarczanu (wskaźnik - skrobia). W tym samym czasie przeprowadzane jest również oznaczenie kontrolne (bez oleju).
Liczba nadtlenkowa pH (liczba gramów jodu uwolnionego przez nadtlenki zawarte w 100 g oleju) oblicza się według wzoru
gdzie c to ilość 0,002 N roztworu tiosiarczanu zużytego podczas oznaczania kontrolnego, to ilość 0,002 N roztworu tiosiarczanu zużytego podczas miareczkowania prototypu, ml; k jest współczynnikiem korygującym dla roztworu tiosiarczanu; 0,0002538 - miano 0,002 N roztworu tiosiarczanu w jodze (1 ml roztworu odpowiada 0,0002538 g jodu); n - waga oleju, g.
Jakościowa reakcja na aldehydy (z odczynnikiem Schiffa).
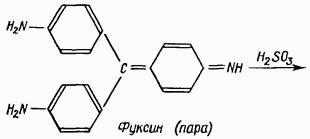
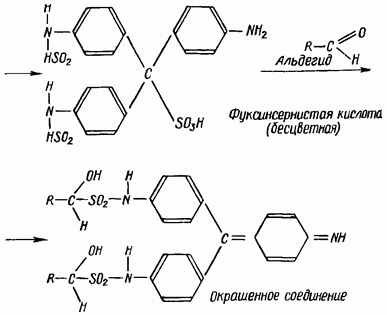
Jedną z najbardziej specyficznych jest reakcja aldehydów z kwasem fuksynosiarczanowym (odczynnik Schiffa). Bezbarwny roztwór fuksyny kwasu siarkowego pod wpływem aldehydów przybiera barwę czerwono-fioletową lub niebiesko-fioletową.
Reakcja przebiega według następującego schematu:
Odczynniki. odczynnik Schiffa; można przygotować na dwa sposoby: a) 0,5 g fuksyny rozpuszcza się w 500 ml wody i filtruje. 500 ml wody nasyca się dwutlenkiem siarki. Oba roztwory wylewa się razem i pozostawia na 10-12 h. Przechowywać w ciemnym miejscu; b) wlać 30 ml 0,1% alkoholowego roztworu fuksyny do 250 ml kolby miarowej, dodać 15 ml 32% fuksyny roztwór wodny woda siarczku sodu. Zawartość kolby delikatnie miesza się i pozostawia na 1 godzinę, po czym dodaje się 16 ml rozcieńczonego kwasu siarkowego (1:3) i uzupełnia do kreski 50% alkoholem etylowym. Przechowywać w ciemnej szklanej butelce lub w ciemnym miejscu. Podczas badania olejów preferowane jest użycie odczynnika przygotowanego zgodnie z drugą metodą.
Do probówki wlać 5-6 ml oleju, dodać 2-3 ml odczynnika Schiffa i wstrząsnąć. W obecności aldehydów ciecz zmieni kolor na niebiesko-fioletowy lub czerwono-fioletowy. Maksymalne zabarwienie rozwija się w 15-16 minut. Jeśli kolor nie pojawi się po 20 min. po rozpoczęciu eksperymentu wskazuje to na brak aldehydów w oleju.
Separacja i identyfikacja wyższych nasyconych kwasów tłuszczowych metodą chromatografii bibułowej.
Informacje ogólne. Korzystając z opisanej metody
możliwe jest wyodrębnienie i zidentyfikowanie najwyższych granicznych (nasyconych) kwasów tłuszczowych, które zawierają od 12 do 24 atomów węgla.
Ogólna procedura rozdzielania substancji organicznych na papierze została opisana powyżej (patrz „Chromatografia z podziałem aminokwasów na papierze”).
Do chromatografii kwasów tłuszczowych stosuje się specjalnie przygotowany papier hydrofobowy. Wyższe kwasy tłuszczowe są substancjami hydrofobowymi, dlatego podczas chromatografii wyklucza się stosowanie wody jako fazy stacjonarnej. Rolę fazy ruchomej pełni zwykle lodowaty kwas octowy lub mieszanina kwasu octowego z kwasem mrówkowym i wodą (30:10:1).
Krany: palmitynowy, stearynowy i inne wyższe nasycone kwasy tłuszczowe.
Przygotowanie papieru chromatograficznego. Bibułę przemywa się 0,5% roztworem kwasu solnego przez 3 minuty, po czym przemywa 5-6 razy wodą destylowaną, 3 razy alkoholem etylowym i 4-5 razy eterem dietylowym, a następnie suszy na powietrzu (praca jest prowadzone pod ciągiem, z urządzeniami grzewczymi, z zachowaniem środków przeciwpożarowych).
Umyty i wysuszony papier tnie się na paski o szerokości 1-2 cm i długości 30-35 cm, jedną krawędź każdego paska przekłuwa się igłą i nicią, tworząc pętlę. Do hydrofobizacji paski są opuszczane do cylindra ze szlifowanym korkiem, na którego dno (warstwa o wysokości 4-6 cm) wylewa się roztwór benzenu olej wazelinowy. Pętle nici są umieszczane pod korkiem, a naczynie jest szczelnie zamykane. Paski usuwa się, gdy roztwór osiągnie górną krawędź papieru (1 cm przed pętlą) i suszy w temperaturze pokojowej (pod wyciągiem). Po obróbce naftą paski zanurza się w płynie na 1 minutę, następnie wyjmuje, ściska wałkiem między dwoma arkuszami bibuły filtracyjnej i suszy w pozycji wiszącej w temperaturze pokojowej (pod wyciągiem).
Izolacja mieszaniny kwasów tłuszczowych. Do kolby stożkowej dodaje się 2-3 g tłuszczu i dodaje 20-25 ml 25% alkoholowego roztworu potażu kaustycznego. Kolbę szczelnie zamyka się chłodnicą zwrotną, umieszcza się we wrzącej łaźni wodnej i tłuszcz zmydla się przez 35-40 minut. Do roztworu mydła w kolbie dodaj 25-30 ml gorąca woda i wymieszać. Roztwór wlewa się do parownicy i podgrzewa w gorącej łaźni wodnej (temperatura wody nie wyższa niż 85 ° C) aż do całkowitego zaniku zapachu alkoholu. Do płynu w kubku dodaje się kilka mililitrów roztworu kwasu siarkowego (1:3), aż warstwa kwasu tłuszczowego zostanie całkowicie odizolowana. Zawartość kubka ostrożnie wlewa się do rozdzielacza. Wodną warstwę kwasu oddziela się, a warstwę kwasu tłuszczowego przemywa się kilkakrotnie ciepłą wodą, aż popłuczyny staną się obojętne w oranżu metylowym. Przemytą warstwę kwasu tłuszczowego filtruje się przez suchą bibułę filtracyjną do ciemnej butelki ze zmielonym korkiem i przechowuje w lodówce.
Do chromatografii przygotowuje się roztwór kwasów tłuszczowych w toluenie lub acetonie, alkoholu metylowym lub mieszaninie alkoholu etylowego i eteru dietylowego. Oddzielnie przygotuj roztwór kranów (w tym samym rozpuszczalniku). Stężenie kwasów w roztworach dobiera się tak, aby kropla naniesiona na papier za pomocą mikropipety zawierała 10–25 μg każdego kwasu.
Chromatografia. W odległości 1-1,5 cm od dolnej krawędzi paska papieru z grafitem
ołówkiem rysuje się linię prostą, na którą za pomocą mikropipety nanosi się kroplę roztworu testowego. Kroplę roztworu z kranu nakłada się na inny podobny pasek. Krople suszy się na powietrzu.
Separację przeprowadza się w szklanych cylindrach ze szlifowanymi korkami w temperaturze pokojowej. Na dno cylindra wlewa się lodowaty kwas octowy lub mieszaninę kwasu octowego, mrówkowego i wody. Pasek zawieszony jest na pętelce nici, którą wprowadza się pod korek tak, aby dolna krawędź papieru była zanurzona w cieczy na 3-5 mm.
Ryż. 12. Chromatogram kwasów tłuszczowych.
Po podniesieniu się rozpuszczalnika na papierze o 26-28 cm paski usuwa się i suszy w temperaturze pokojowej, następnie przemywa wodą destylowaną i ponownie suszy.
Roztwór zasadowego azotanu bizmutu wlewa się do kąpieli fotograficznej, w której umieszcza się chromatogramy na 10-15 minut, następnie przenosi się do kolejnej kąpieli z wodą destylowaną, którą zmienia się 10-12 razy. Dobrze umyte paski spryskuje się roztworem siarczku amonu (lub umieszcza się w kąpieli z roztworem): pojawiają się czarne plamy kwasów tłuszczowych (ryc. 12). Chromatogramy przemywa się 5-6 razy wodą destylowaną i suszy na powietrzu. Policz każdy kwas
na chromatogramach doświadczalnych i kontrolnych (z kranami) oraz przez zbieżność ich miejsc określa się skład kwasów badanego tłuszczu.
